Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình phản ứng khí C 2 H 2 cháy:
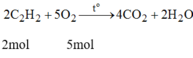
Để có phản ứng cháy xảy ra ở nhiệt độ cao nhất thì tỉ lệ thể tích:
V C 2 H 2 : V O 2 = 2 : 5 = 1 : 2,5
Ứng dụng của phản ứng này dùng trong xì đèn.
Oxi – axetilen để hàn và cắt kim loại

\(\dfrac{mH2}{mO2}\)=\(\dfrac{3}{8}\)=x
=>;mH2=x=>nH2=\(\dfrac{3x}{2}\)mol
m02=\(\dfrac{8x}{32}\)=\(\dfrac{x}{4}\)mol
PTHH: 2H2 + O2 to→ 2H2O
xét: \(\dfrac{3x}{2}\);\(\dfrac{3x}{12}\)
h2 dư, o2 hết
nh2dư=\(\dfrac{3x}{2}-\dfrac{3x}{12}\)\(=\dfrac{15x}{12}\)=\(\dfrac{1,792}{22,4}\)=0,08(mol)
=>x=\(\dfrac{0,08.12}{15}\)=0,064
nO2=\(\dfrac{0,064}{4}\)=0,016(mol)
nH2=\(\dfrac{0,064.3}{2}\)=0,096(mol)
VQ(đktc)=22,4(0,016+0,096)=2,5088(lít)

Gọi số mol H2, O2 là a, b (mol)
Ta có: \(\dfrac{m_{H_2}}{m_{O_2}}=\dfrac{3}{8}\)
=> \(\dfrac{2a}{32b}=\dfrac{3}{8}\Rightarrow\dfrac{a}{b}=\dfrac{6}{1}\) hay a = 6b
PTHH: 2H2 + O2 --to--> 2H2O
Xét tỉ lệ: \(\dfrac{6b}{2}>\dfrac{b}{1}\) => H2 dư, O2 hết
PTHH: 2H2 + O2 --to--> 2H2O
2b<---b
=> \(n_{H_2\left(dư\right)}=6b-2b=4b=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
=> b = 0,02 (mol)
=> a = 0,12 (mol)
=> VQ = (0,02 + 0,12).22,4 = 3,136 (l)

a) Phương trình phản ứng:
2CO + O2 → 2CO2
b) Theo phương trình 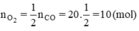
c) Hoàn chỉnh bảng
Thời điểm t1 nCO còn 15mol ⇒ nCO đã phản ứng = 20 - 15= 5mol
Theo pt nCO2 = nCO(pư) = 5 mol
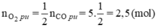 ⇒ nO2 còn lại = 10 - 2,5 = 7,5 mol
⇒ nO2 còn lại = 10 - 2,5 = 7,5 mol
Tương tự tính thời điểm t2 và thời điểm t3 ta được số liệu sau:
| Số mol | |||
| Các thời điểm | Các chất phản ứng | Sản phẩm | |
| CO | O2 | CO2 | |
| Thời điểm ban đầu t0 | 20 | 10 | 0 |
| Thời điểm t1 | 15 | 7,5 | 5 |
| Thời điểm t2 | 3 | 1,5 | 17 |
| Thời điểm kết thúc t3 | 0 | 0 | 20 |

a,
2H2+ O2 (t*)-> 2H2O
CH4+ 2O2 (t*)-> CO2+ 2H2O
M X= 0,325.32= 10,4
nX= 11,2/22,4= 0,5 mol
Gọi x là nH2, y là nCH4
Ta có 2x+16yx+y=10,42x+16yx+y=10,4
<=> 8,4x= 5,6y
<=> xy=5,68,4=23xy=5,68,4=23
Vậy nếu mol H2 là 2x thì mol CH4 là 3x
=> 2x+ 3x= 0,5 <=> x= 0,1
=> nH2= 0,2 mol; nCH4= 0,3 mol
%H2= 0,2.1000,50,2.1000,5= 40%
%CH4= 60%
b,
nO2= 28,8/32= 0,9 mol
Spu đốt H2, tạo ra 0,2 mol H2O; đã dùng 0,1 mol O2
Spu đôts CH4, tạo ra 0,3 mol CO2; 0,6 mol H2O; đã dùng 0,6 mol O2
=> Dư 0,2 mol O2
Sau khi ngưng tụ nước còn lại hh khí gồm 0,3 mol CO2; 0,2 mol O2
%V CO2= 0,3.1000,3+0,20,3.1000,3+0,2= 60%
%V O2= 40%
mCO2= 0,3.44= 13,2g
mO2= 0,2.32= 6,4g
%m CO2= 13,2.1006,4+13,213,2.1006,4+13,2= 67,3%
%m O2= 32,7%

Câu 8:
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{2}< \dfrac{0,2}{1}\), ta được O2 dư.
Theo PT: \(\left\{{}\begin{matrix}n_{O_2\left(pư\right)}=\dfrac{1}{2}n_{H_2}=0,05\left(mol\right)\\n_{H_2O}=n_{H_2}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{O_2\left(dư\right)}=0,15\left(mol\right)\)
\(\Rightarrow V_{O_2\left(dư\right)}=0,15.22,4=3,36\left(l\right)\)
\(m_{H_2O}=0,1.18=1,8\left(g\right)\)
Bạn tham khảo nhé!
Câu 9:
a, PT: \(2R+O_2\underrightarrow{t^o}2RO\)
Theo ĐLBT KL, có: mR + mO2 = mRO
⇒ mO2 = 4,8 (g)
\(\Rightarrow n_{O_2}=\dfrac{4,8}{32}=0,15\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,15.22,4=3,36\left(l\right)\)
b, Theo PT: \(n_R=2n_{O_2}=0,3\left(mol\right)\)
\(\Rightarrow M_R=\dfrac{19,2}{0,3}=64\left(g/mol\right)\)
Vậy: M là đồng (Cu).
Câu 10:
Ta có: mBaCl2 = 200.15% = 30 (g)
a, m dd = 200 + 100 = 300 (g)
\(\Rightarrow C\%_{BaCl_2}=\dfrac{30}{300}.100\%=10\%\)
⇒ Nồng độ dung dịch giảm 5%
b, Ta có: \(C\%_{BaCl_2}=\dfrac{30}{150}.100\%=20\%\)
⇒ Nồng độ dung dịch tăng 5%.
Bạn tham khảo nhé!