Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
Ta có: \(\left\{{}\begin{matrix}m_{H_2SO_4}=588\cdot5\%=29,4\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{29,4}{98}=0,3\left(mol\right)\\n_{Al_2O_3}=\dfrac{20,4}{102}=0,2\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,3}{3}\) \(\Rightarrow\) Al2O3 còn dư
\(\Rightarrow n_{Al_2\left(SO_4\right)_3}=0,1\left(mol\right)=n_{Al_2O_3\left(dư\right)}\)
\(\Rightarrow C\%_{Al_2\left(SO_4\right)_3}=\dfrac{0,1\cdot342}{20,4+588-0,1\cdot102}\cdot100\%\approx5,72\%\)

alo giúp mik Nhân dịp đi du lịch về, Mai mang đến lớp 51 móc chìa khóa để tặng cho cácbạn. Sau khi chia hết cho các bạn (tính cả mình) thì Mai còn thừa3chiếc. Hỏi lớpMai có bao nhiêu bạn, biết số học sinh nhiều hơn 20 và ít hơn 30 bạn.

d) Gọi x,y lần lượt là số mol Al, Fe
\(\left\{{}\begin{matrix}27x+56y=8,3\\1,5x+y=0,25\end{matrix}\right.\)
=> x=0,1 ; y=0,1
Kết tủa : Al(OH)3, Fe(OH)2
Bảo toàn nguyên tố Al: \(n_{Al\left(OH\right)_3}=n_{Al}=0,1\left(mol\right)\)
Bảo toàn nguyên tố Fe: \(n_{Fe\left(OH\right)_2}=n_{Fe}=0,1\left(mol\right)\)
=> \(m=0,1.78+0,1.90=16,8\left(g\right)\)
Nung kết tủa thu được chất rắn : Al2O3 và FeO
Bảo toàn nguyên tố Al: \(n_{Al_2O_3}.2=n_{Al}\Rightarrow n_{Al_2O_3}=0,05\left(mol\right)\)
Bảo toàn nguyên tố Fe: \(n_{FeO}=n_{Fe}=0,1\left(mol\right)\)
=> \(a=0,05.102+0,1.72=12,3\left(g\right)\)

Bài 4 :
\(n_{H2}=\dfrac{V_{H2}}{22,4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Pt : \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2|\)
2 3 1 3
0,1 0,15 0,05 0,15
a) \(n_{Al}=\dfrac{0,15.2}{3}=0,1\left(mol\right)\)
⇒ \(m_{Al}=n_{Al}.M_{Al}\)
= 0,1 . 27
= 2,7 (g)
\(m_{Cu}=10-2,7=7,3\left(g\right)\)
0/0Al = \(\dfrac{m_{Al}.100}{m_{hh}}=\dfrac{2,7.100}{10}=27\)0/0
0/0Cu = \(\dfrac{m_{Cu}.100}{m_{hh}}=\dfrac{7,3.100}{10}=13\)0/0
b) \(n_{Al2\left(SO4\right)3}=\dfrac{0,15.1}{3}=0,05\left(mol\right)\)
⇒ \(m_{Al2\left(SO4\right)3}=n_{Al2\left(SO4\right)3.}M_{Al2\left(SO4\right)3}\)
= 0,05 . 342
= 17,1 (g)
\(n_{H2SO4}=\dfrac{0,1.3}{2}=0,15\left(mol\right)\)
⇒ \(m_{H2SO4}=n_{H2SO4}.M_{H2SO4}\)
= 0,15 .98
= 14,7 (g)
\(C_{H2SO4}=\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\)\(\dfrac{14,7.100}{15}=98\left(g\right)\)
mdung dịch sau phản ứng = (mAl + mCu) + mH2SO4 - mH2
= 10 + 98 - (0,15 . 2)
=107,7 (g)
\(C_{Al2\left(SO4\right)3}=\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{17,1.100}{107,7}=15,88\)0/0
Chúc bạn học tốt

Bài 2) Ở 90 độ C:
- 100 gam nước hoà tan 50 gam KCl để tạo 150 gam dung dịch bão hoà ở nhiệt độ này
a) C% của dung dịch bão hoà tại 90 độ C là:
(Khối lượng chất tan/Khối lượng dung dịch) . 100%
<=> (50:150).100% = 33,33%
b) Ở 0 độ C:
Gọi m là khối lượng chất tan KCl ở 0o C => Khối lượng dung dịch tại nhiệt độ này là: 100+m
Theo đề bài ra ta có: m/100+m = 25,93%
=> m = 35 gam
Vậy ở 0 độ C độ tan của KCl trong nước là 35 gam
c) Ở 90 độ C:
100 gam nước hoà tan 50 gam KCl tạo 150 gam dd
=> 600 gam dung dịch tạo 200 gam KCl và 400 gam nước
- Ở 0 độ C:
100 gam nước hoà tan 35 gam KCl tạo 135 gam dd
=> 400 gam nước hoà tan được 140 gam KCl tạo 400 + 140 = 540 gam dung dịch
Vậy khi làm lạnh 600 gam dung dịch KCl từ 90 độ xuống 0 độ thì khối lượng dung dịch thu được là 540 gam

Bài 1:
(1) \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
(2) \(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
(3) \(AlCl_3+3KOH\rightarrow3KCl+Al\left(OH\right)_3\downarrow\)
(4) \(Al\left(OH\right)_3+3HCl\rightarrow AlCl_3+3H_2O\)
(5) \(2Al\left(OH\right)_3\xrightarrow[]{t^o}Al_2O_3+3H_2O\)
(6) \(Al\left(OH\right)_3+NaOH\rightarrow NaAlO_2+2H_2O\)
(7) \(Al_2O_3+2NaOH\rightarrow2NaAlO_2+H_2O\)
(8) \(Al+NaOH+H_2O\rightarrow NaAlO_2+\dfrac{3}{2}H_2\uparrow\)
(9) \(2Al_2O_3\xrightarrow[criolit]{đpnc}4Al+3O_2\)
Bài 2:
PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
a_______a_______a_____a (mol)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
b_______b________b____b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}56a+24b=21,6\\a+b=\dfrac{11,2}{22,4}=0,5\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,3\\b=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,3\cdot56}{21,6}\cdot100\%\approx77,78\%\\\%m_{Mg}=22,22\%\end{matrix}\right.\)
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{Mg\left(OH\right)_2}=n_{Mg}=0,2\left(mol\right)\\n_{Fe\left(OH\right)_2}=n_{Fe}=0,3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{kết.tủa}=m_{Fe\left(OH\right)_3}+m_{Mg\left(OH\right)_2}=0,3\cdot107+0,2\cdot56=43,3\left(g\right)\)
Theo các PTHH: \(n_{H_2SO_4\left(p/ứ\right)}=0,5\left(mol\right)\) \(\Rightarrow n_{H_2SO_4\left(ban.đầu\right)}=0,5\cdot120\%=0,6\left(mol\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,6\cdot98}{10\%}=588\left(g\right)\)
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{MgO}=n_{Mg}=0,2\left(mol\right)\\n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{chất.rắn}=m_{MgO}+m_{Fe_2O_3}=0,2\cdot40+0,15\cdot160=32\left(g\right)\)

$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O(1)$
$Fe_2(SO_4)_3 + Fe\ to 3FeSO_4(2)$
Gọi $n_{Fe_2(SO_4)_3} = a(mol) ; n_{FeSO_4} = b(mol)$
Ta có : $400a + 152b = 62,8(1)$
$n_{SO_2} = 0,15(mol)$
$n_{Fe_2(SO_4)_3(1)} = \dfrac{1}{3}n_{SO_2} = 0,05(mol)$
$n_{Fe_2(SO_4)_3(2)} = \dfrac{1}{3}n_{FeSO_4} = \dfrac{b}{3}$
Suy ra:
$0,05 - \dfrac{b}{3} = a(2)$
Từ (1)(2) suy ra $a = \dfrac{45}{112} ; b = -1,055<0$
=> Sai đề

X: Fe3O4
Y: FeCl2
Z: FeCl3
T: Fe(OH)2
U: Fe(OH)3
A: NaCl (hoặc H2O)
B: H2O (hoặc NaCl)
D: H2 (hoặc Cl2)
E: Cl2 (hoặc H2)
F: NaOH
G: HCl
PTHH:
a) NaCl + H2O -dpmn----> 1/2 H2 + 1/2 Cl2 + NaOH
H2 + Cl2 -to-> 2 HCl
HCl + NaOH -> NaCl + H2O
b) 3 Fe +2 O2 -to->Fe3O4
Fe3O4 + 8 HCl -> FeCl2 +2 FeCl3 + H2O
FeCl2 + 2 NaOH -> Fe(OH)2 + 2 NaCl
FeCl3 +3 NaOH -> Fe(OH)3 + 3NaCl
Chúc em học tốt!


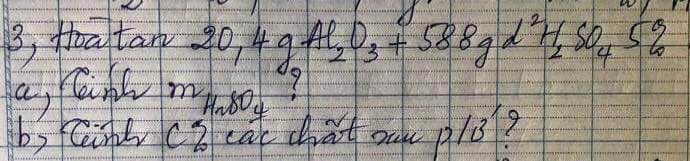






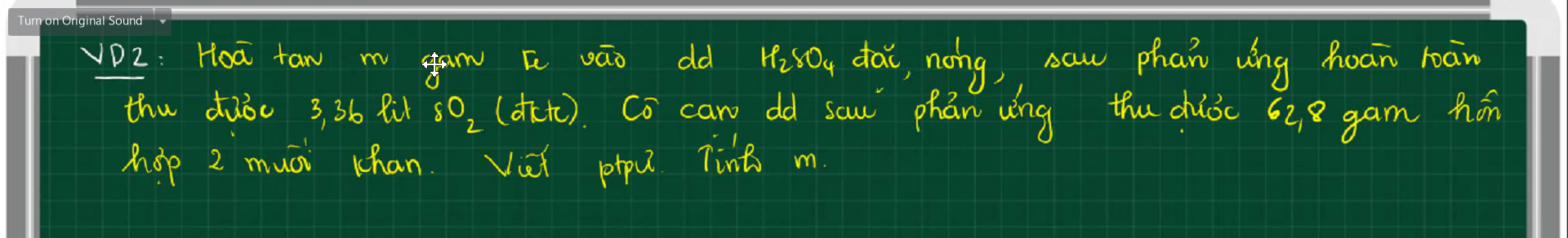

PTHH: Al2O3+6HCl➝2AlCl3+3H2O(1)
a)nAl2O3=\(\dfrac{10,2}{102}\)=0,1(mol)
mHCl=\(\dfrac{5\%.219}{100\%}\)=10,95(g)
⇒nHCl=\(\dfrac{10,95}{36,5}\)=0,3(mol)
Xét tỉ lệ Al2O3:\(\dfrac{0,1}{1}\)=0,1
Xét tỉ lệ HCl:\(\dfrac{0,3}{6}\)=0,05
⇒HCl pứng hết,Al2O3 còn dư
Theo PTHH(1) ta có nAl2O3 pứng=\(\dfrac{nHCl}{6}\)=\(\dfrac{0,3}{6}\)=0,05(mol)
⇒nAl2O3 dư=nAl2O3ban đầu-nAl2O3 pứng=0,1-0,05=0,05(mol)
⇒mAl2O3 dư=0,05.102=5,1(g)
b) C%HCl=\(\dfrac{0,3.36,5}{219+10,2}\).100%=4,8%
nAlCl3=0,1(mol)
⇒C%AlCl3=\(\dfrac{0,1.136,5}{10,2+219}\).100%=6%