Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ở cùng điều kiện nhiệt độ và áp suất thì tỉ lệ về thể tích cũng chính là tỉ lệ về số mol

⇒ Chọn B.

Có phương trình cháy
4NH3+3O2->2N2+6H2O
CxHy+(x+y/4)O2->xCO2+(y/2)H2O
Theo dữ kiện bài toán sau khi đốt cháy tạo 100 ml ni tơ
Thực tết thhu được thể tích N2 nhỏ hơn 2 lần hỗn hợp đầu
->V NH3 ban đầu là 100*2=200ml
->V CxHy ban đầu = 100ml
Sau khi đốt tạo 550-250=300 ml CO2
và 1250-550-300=400 ml nước
Có tỉ lệ
CxHy+(x+y/4)O2->xCO2+(y/2)H2O
100------------------300--------400
->x=3
y=8
Vậy CT C3H8

Vì bài toán chỉ có số liệu tương đối (%) nên để đơn giản và không mất tính tổng quát, ta có thể chọn số mol một chất bất kì. Ta chọn nX = 1(mol)
![]()
Khi làm lạnh thì hơi nước ngưng tụ vậy Y chỉ chứa CO2 và O2 dư.
Pt:
CxHy + (x + 0,25y)O2 → xCO2 + 0,5yH2O
a → a(x + 0,25y) ax 0,5ay
dư: 1 – a – a(x + 0,25y)

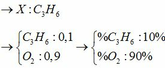

Biết 1 lít hỗn hợp A ở dạng khí nặng gấp hai lần 1 lít khí C 2 H 6 ở cùng điều kiện.
⇒ n A = n C 2 H 6 ⇒ M A = 2 M C 2 H 6
(cùng điều kiện nên tỉ lệ thể tích chính là tỉ lệ số mol)
Ba chất có cùng công thức phân tử ⇒ có cùng khối lượng mol phân tử : M = 2.30 = 60 (gam/mol). Khi đốt cháy hỗn hợp A thu được CO 2 , H 2 O → công thức phân tử của các chất có dạng C x H y O z
Phương trình hoá học
C x H y O z + (x + y/4 - z/2) O 2 → x CO 2 + y/2 H 2 O
CO 2 + Ca OH 2 → Ca CO 3 + H 2 O
Ta có : n CO 2 = n CaCO 3 = 15/100 = 0,15mol
Theo định luật bảo toàn khối lượng, ta có :
m A + m O = m CO 2 + m H 2 O
⇒ 3 + 7,2 = 0,15 x 44 + m H 2 O ⇒ m H 2 O = 3,6g
n A = 3/60 = 0,05mol; n CO 2 = 0,05x = 0,15 ⇒ x = 3
n H 2 O = 0,05y/2 = 3,6/18 ⇒ y = 8
M A = 12x + y + 16z = 60 ⇒ z = 1 ⇒ ông thức phân tử của A là C 3 H 8 O
Công thức cấu tạo của ba chất là : CH 3 CH 2 CH 2 OH
CH 3 CHOH CH 3
CH 3 -O- CH 2 CH 3

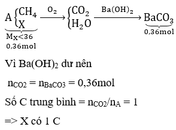
a) MX = 146g/mol
VCO2 : VH2O = 6 : 5
=> nC : nH = 3 : 5
=> CTĐGN: (C3H5Oa)n
→ (41 + 16a).n = 146 → (a; n) = (4; 2) → X: C6H10O4
b) C6H10O4 + 6,5O2 → 6CO2 + 5H2O
0,05 0,325
=> p = 7,3g
c)
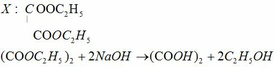

làm sao biết được đó là ankan và Nito có phản ứng với O2 ra NO mà ?
Giả sử các khí đều đo ở đktc
\(CTHH:C_nH_{2n+2}\)(n là số tự nhiên khác 0)
\(V_{H_2O}=1,4-0,8=0,6\left(l\right)\)
\(V_{CO_2}=0,8-0,4=0,4\left(mol\right)\)
=> \(\left\{{}\begin{matrix}n_{H_2O}=\frac{0,6}{22,4}=\frac{3}{112}\left(mol\right)\\n_{CO_2}=\frac{0,4}{22,4}=\frac{1}{56}\left(mol\right)\end{matrix}\right.\)
Bảo toàn H: \(n_{H\left(X\right)}=2.n_{H_2O}=\frac{3}{56}\left(mol\right)\)
Bảo toàn C: \(n_{C\left(X\right)}=n_{CO_2}=\frac{1}{56}\left(mol\right)\)
=> \(\frac{n_C}{n_H}=\frac{\frac{1}{56}}{\frac{3}{56}}=\frac{1}{3}\) => \(\frac{n}{2n+2}=\frac{1}{3}=>n=2\)
=> CTHH: \(C_2H_6\)

Vì hợp chất A đốt cháy bằng oxi thu được sản phẩm chỉ gồm CO2 và H2O
Nên A gồm 3 nguyên tố C, H và O
gọi CTHH là CxHyOz
PTHH
CxHyOz + \(\left(x+\frac{y}{4}-\frac{z}{2}\right)\) O2 ----> xCO2 + \(\frac{y}{2}\) H2O ( 1 )
0,05 ----\(\left(x+\frac{y}{4}-\frac{z}{2}\right)0,05\)----0,05x
Ca(OH)2 + CO2 ---> CaCO3 + H2O
Có n CaCO3 = 15/100 = 0,15 ( mol )
=> n CO2 = 0,15 ( mol )
Vì 1 lít hỗn hợp dạng khí nặng gấp 2 lần 1 lít khí C2H6 cùng tiêu chuẩn
=> \(\hept{\begin{cases}n_{CxHyOz}=n_{C2H6}\\m_{CxHyOz}=2m_{C2H6}\end{cases}}\)
=> M CxHyOz = 2M C2H6
=> M CxHyOz = 2 . 30 = 60 => 12x + y + 16z = 60
=> n CxHyOz = 3/60 = 0,05 ( mol )
Theo ( 1 ) : 0,05x = 0,15 => x = 3
Do đó y + 16z = 60 - 12x3 = 24 ( 2 )
Có n O2 = 7,2 : 32 = 0,225 ( mol )
=> \(\left(x+\frac{y}{4}-\frac{z}{2}\right)0,05=0,225\)
\(\Rightarrow x+\frac{y}{4}-\frac{z}{2}=4,5\)
\(\Rightarrow\frac{y}{4}-\frac{z}{2}=4,5-3=1,5\)
\(\Rightarrow y-2y=6\) ( 3 )
Theo ( 2 ) và ( 3 ) ta có hpt
\(\hept{\begin{cases}y+16z=24\\y-2z=6\end{cases}\Rightarrow\hept{\begin{cases}y=8\\z=1\end{cases}}}\)
Vậy CT là C3H8O