
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{NO}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(3R+8HNO_3\rightarrow3R\left(NO_3\right)_2+2NO+4H_2O\)
từ pthh suy ra: \(n_R=\dfrac{3}{2}.n_{NO}=\dfrac{3}{2}.0,1=0,15\left(mol\right)\)
=> \(M_R=\dfrac{9,75}{0,15}=65\)
Vậy tên của R: kẽm (Zn)

\(CuO+CO\underrightarrow{t^o}Cu+CO_2\)
\(MgO+CO->\left(CO.ko.khử,đc\right)\)
\(Fe_2O_3+3CO\underrightarrow{t^o}2Fe+3CO_2\)
\(FeO+CO\underrightarrow{t^o}Fe+CO_2\)
\(n_{CO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Từ các pthh trên thấy: \(n_{CO_2.sinh.ra}=n_{CO.pứ}=0,2\left(mol\right)\left(theo.tỉ.lệ.pthh\right)\)
Áp dụng ĐLBTKL có: \(m_{hh}+m_{CO}=m_{rắn}+mCO_2\)
=> \(m_{rắn}=m_{hh}+m_{CO}-m_{CO_2}=12,5+0,2.28-0,2.44=9,3\left(g\right)\)

a)
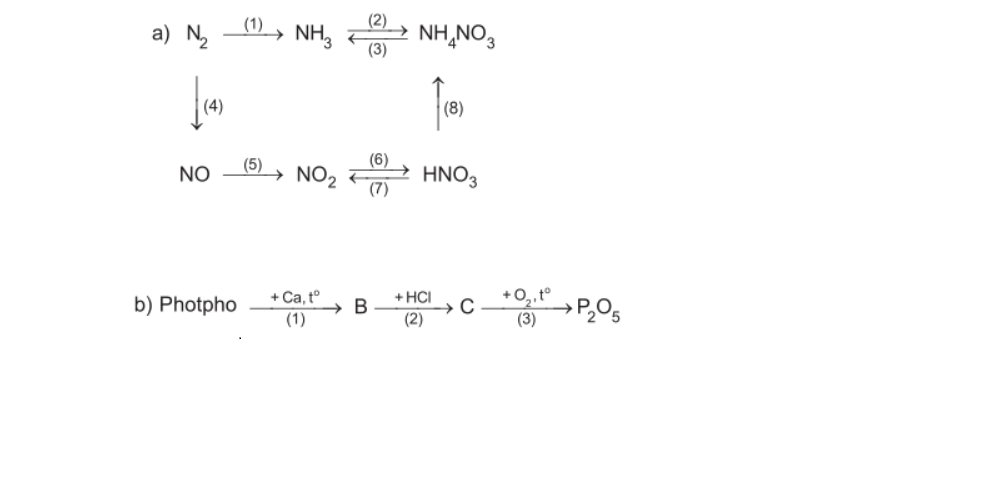
\(\left(1\right)N_2+3H_2⇌\left(xt,t^o,P\right)2NH_3\\ \left(2\right)NH_3+HNO_3\rightarrow NH_4NO_3\\ \left(3\right)NH_4NO_3+KOH\rightarrow KNO_3+NH_3+H_2O\\ \left(4\right)N_2+O_2⇌\left(3000^oC\right)2NO\\ \left(5\right)2NO+O_2\rightarrow2NO_2\\ \left(6\right)4NO_2+O_2+2H_2O\rightarrow4HNO_3\\ \left(7\right)Cu+4HNO_{3\left(đ\right)}\underrightarrow{t^o}Cu\left(NO_3\right)_2+2NO_2+2H_2O\\ \left(8\right)NH_3+HNO_3\rightarrow NH_4NO_3\)
b)
\(\left(1\right)2P+3Ca\underrightarrow{to}Ca_3P_2\\ \left(2\right)Ca_3P_2+6HCl\rightarrow3CaCl_2+2PH_3\\ \left(3\right)2PH_3+4O_2\underrightarrow{to}P_2O_5+3H_2O\)
Lưu ý đối với các phản ứng 2 chiều, mình không có thêm được điều kiện trên mũi tên phản ứng (do đặc thù của latex hoc24.vn) vì thế mình có mở ngoặc sau, bạn nào sau này thấy thì trong ngoặc là đk phản ứng nhé!

VD có pt A+B=>C+D
dòng ban đầu: ghi lần lượt nồng độ của A,B,C,D (nếu có)
pứ: Gọi A pứ xM
cân bằng: nồng độ các chất tại thời điểm cân bằng xác định bằng qui tắc chuyển dịch cân bằng Lơsatơliê
A + B <=> C + D
bđ:a M b M c M d M
pứ:x M => x M => x M =>x M
cb:a-x M b-x M c+x M d+x M



sách giải quá khó hiểu
mình giải bài 1.19 lại như sau
nHF=4/20=0,2mol
=>[HF]=0,2/2=0,1mol
ADCT: \(\alpha\)=\(\dfrac{\left[điệnli\right]}{\left[banđầu\right]}\)
<=>8%=\(\dfrac{\left[HFđiệnli\right]}{0,1}\)=>[HF đl]=0,008M
AD phương pháp 3 dòng:
----------HF\(\Leftrightarrow\)H++F-
Ban đầu:0,1---0---0
Điện li: 0,008--0,008--0,008
Sau đl:(0,1-0,008)----0,008-----0,008M
vì HF là axit yếu nên ta có CT sau:
Ka=\(\dfrac{\left[H^+\right].\left[F^-\right]}{\left[HFsauđiênli\right]}\)
Ka=\(\dfrac{\left(0,008\right)^2}{0,1-0,008}=\)=0,696.10-3




 tập dạng 2 với
tập dạng 2 với


 ở lời giải câu 1.13 chỗ 2. em không hiểu chỗ
ở lời giải câu 1.13 chỗ 2. em không hiểu chỗ
\(n_{N_2}=\dfrac{1792:1000}{22,4}=0,08\left(mol\right)\)
\(5Mg+12HNO_3\rightarrow5Mg\left(NO_3\right)_2+N_2+6H_2O\)
x x \(\dfrac{1}{5}x\)
\(10Al+36HNO_3\rightarrow10Al\left(NO_3\right)_3+3N_2+18H_2O\)
y y \(\dfrac{3}{10}y\)
gọi x và y là số mol của Mg và Al
có hệ: \(\left\{{}\begin{matrix}\dfrac{1}{5}x+\dfrac{3}{10}=0,08\\24+27y=7,8\end{matrix}\right.\)
=> x = 0,1 và y = 0,2
=> \(m_{muôií}=m_{Mg\left(NO_3\right)_2}+m_{Al\left(NO_3\right)_3}=0,1.148+0,2.213=57,4\left(g\right)\)