
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


bạn bấm máy tính hoặc giải hệ:
\(\left\{{}\begin{matrix}27x+56y=11\\1,5x+y=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}27x+56y=11\\84x+56y=22,4\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}57x=11,4\\27x+56y=11\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\27.0,2+56y=11\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)


\(S_{CuSO_4\left(t^o=10^oC\right)}=17,4\left(g\right)\) Đề cho sai rồi
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(n_{H_2SO_4}=n_{CuSO_4}=0,2\left(mol\right)\)
\(m_{H_2SO_4}=0,2.98=19,6\left(g\right)\)
\(m_{dd\left(H_2SO_4\right)}=\dfrac{19,6}{20}.100=98\left(g\right)\)
\(m_{CuSO_4}=0,2.160=32\left(g\right)\)
Khối lượng dung dịch sau khi hòa tan CuO:
\(0,2.80+98=114\left(g\right)\)
Khối lượng nước có trong dung dịch:
\(114-32=82\left(g\right)\)
Gọi a là số mol CuSO4.5H2O tách ra
Khối lượng CuSO4 còn lại trong dung dịch là: 32- 160a
Khối lượng H2O còn lại trong dung dịch là: 82 – 90a
Vì độ tan của CuSO4 ở 100C là 17,4 gam nên ta có:
\(\dfrac{32-160a}{82-90a}=\dfrac{17,4}{100}\)
\(\Rightarrow a\simeq0,12285\left(mol\right)\)
Khối lượng tinh thể đã tách ra: \(0,12285.250=30,7125g\)

C+O2=to=>CO2
1 1 1
a/
no2=\(\frac{v}{22.4}\)=\(\frac{4.48}{22.4}\)=0.2 mol
so sánh tỉ lệ:
\(\frac{n_C}{1}\)=\(\frac{0.3}{1}\)> \(\frac{n_{O2}}{1}\)=\(\frac{0.2}{1}\)
vậy C dư , oxi hết , ta tinh số mol các chất theo nO2
theo pthh ta có nO2=nCO2=0.2 mol
=>mCO2=n *M=0.2*44=8.8 g
b/
nC=\(\frac{m}{M}\)=\(\frac{6}{12}\)=0.5 mol
no2 =\(\frac{v}{22.4}\)=\(\frac{13.44}{22.4}\)=0.6 mol
so sánh tỉ lệ: \(\frac{n_C}{1}\)=\(\frac{0.5}{1}\) < \(\frac{n_{O2}}{1}\)=\(\frac{0.6}{1}\)
vậy oxi dư, cacbon hết ta tính số mol các chất theo nC
theo pthh ta có :nC=nCO2=0.5 mol
=> mCO2=n*M=0.5*44=22 g
a) PTHH: C + O2 -to-> CO2
Ta có:
\(n_{O_2}=\frac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PTHH và đề bài, ta có:
\(\frac{0,3}{1}>\frac{0,2}{1}\)
=> C dư, O2 hết nên tính theo \(n_{O_2}\)
Theo PTHH và đề bài, ta có:
\(n_{CO_2}=n_C=0,2\left(mol\right)\)
Khối lượng khí CO2 thu được sau phản ứng:
\(m_{CO_2}=0,2.44=8,8\left(g\right)\)

Giả sử X có hóa trị n không đổi.
PT: \(4X+nO_2\underrightarrow{t^o}2X_2O_n\)
Ta có: \(n_X=\dfrac{8,1}{M_X}\left(mol\right)\)
\(n_{X_2O_n}=\dfrac{15,3}{2M_X+16n}\left(mol\right)\)
Theo PT: \(n_X=2n_{X_2O_n}\Rightarrow\dfrac{8,1}{M_X}=\dfrac{2.15,3}{2M_X+16n}\Rightarrow M_X=9n\left(g/mol\right)\)
Với n = 3 thì MX = 27 (g/mol) là thỏa mãn.
Vậy: M là Nhôm.

| Thí nghiệm | Hiện tượng | Nhận xét-Dấu hiệu |
| 1 | Giấy cháy thành than | Có sự tạo thành chất mới. Dấu hiệu: Giấy chuyển từ màu trắng sang màu đen |
| 2 | Mẩu nến tan ra thành lỏng rồi thành hơi | Ko tạo thành chất mới |
| 3 | Xuất hiện 1 chất rắn màu trắng | Có sự tạo thành chất mới. Dấu hiệu: Xuất hiện 1 chất ko tan có màu trắng |
| 4 | - Ống 1: thuốc tím tan ra -Ống 2: Có chất rắn màu đen ko tan trong nước | -Ống 1: Ko tạo thành chất mới -Ống 2: Có tạo thành chất mới. Dấu hiệu: Xuất hiện sự thay đổi màu sắc tím sang đen, chất sau khi đun ko tan trong nước |

Bạn sửa Cacbonic thành Cacbon nhá :)
a) Các chất tham gia phản ứng là Amoniac và Cacbon đioxit
b) Sản phẩm tạo thành là ure và nước
c) Điều kiện tối ưu cho phản ứng hóa học này: được diễn ra trong nhiệt độ là 200oC và áp suất là 200atm, cho thêm chất xúc tác vào trong phản ứng.
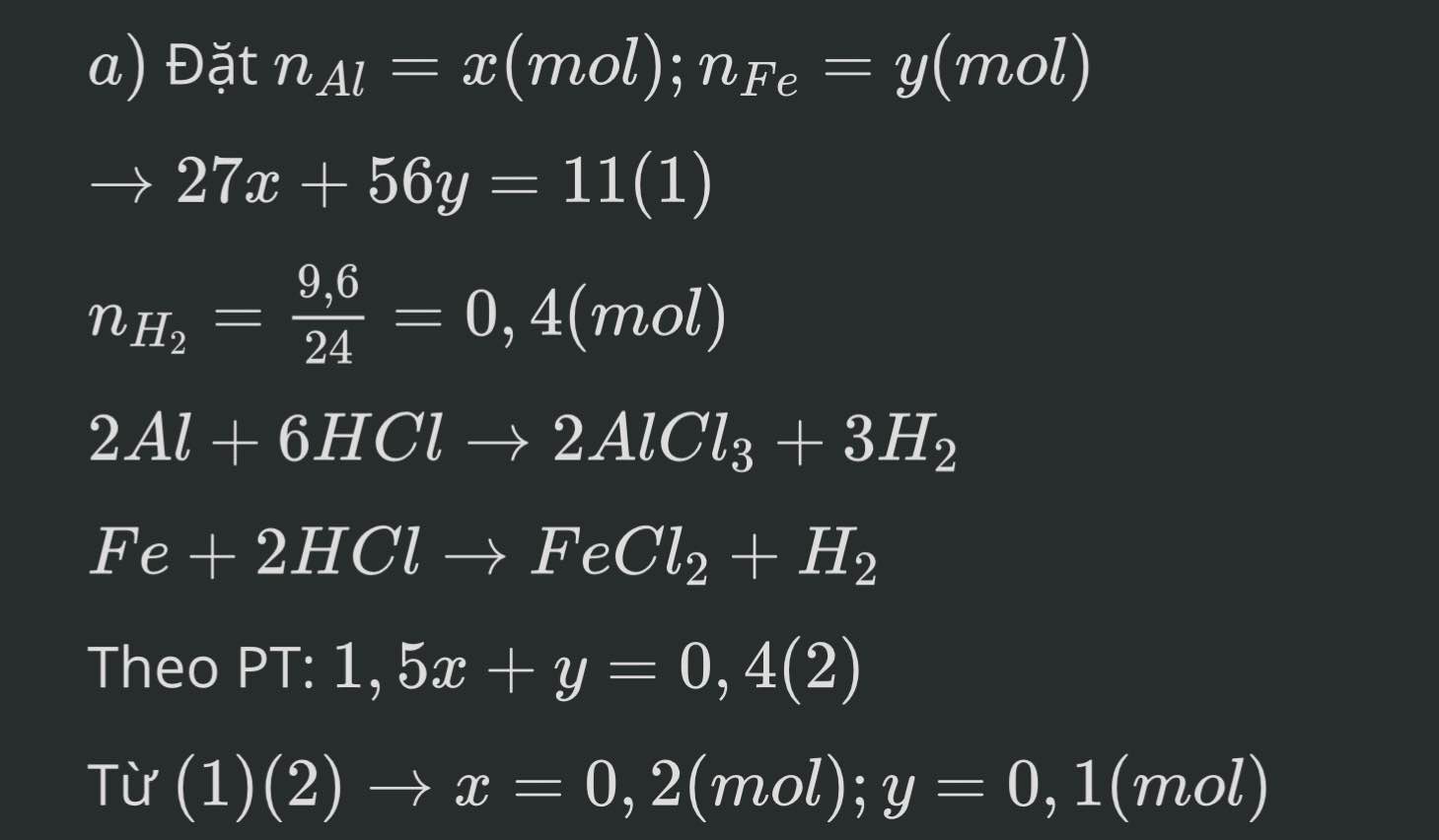
 m giải chi tiết ạ
m giải chi tiết ạ n giúp em với ạ giải chi tiết ạ
n giúp em với ạ giải chi tiết ạ


1 mol chứa 6,022.1023 nguyên tử/ phân tử.
⇒ 0,1 mol H chứa: 0,1.6,022.1023 = 0,6022.1023 (nguyên tử)
10 mol H2O chứa: 10.6,022.1023 = 60,22.1023 (phân tử)
0,24 mol Fe chứa: 0,24.6,022.1023 = 1,44528.1023 (nguyên tử)
0,15 mol CO2 chứa: 0,15.6,022.1023 = 0,9033.1023 (phân tử)
0,01 mol H2 chứa: 0,01.6,022.1023 = 0,06022.1023 (phân tử)
1,44 mol C chứa: 1,44.6,022.1023 = 8,67168.1023 (nguyên tử)
đề bài cho ai không có sách
hãy cho biết số nguyên tử hoặc phân tử có trong những lượng chất sau:
0,1 mol nguyên tử H
10 mol phân tử H\(_2\)O
0,24 MOL NGUYÊN TỬ Fe
0,15 mol phân tử CO\(_2\)
0,01 MOL PHÂN TỬ H\(_2\)
1,44 mol nguyên tử C