Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1:
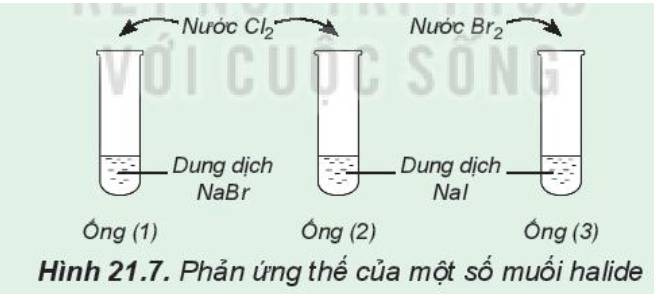
Ống nghiệm (1); dung dịch chuyển sang màu vàng
ống nghiệm (2): dung dịch có màu vàng và có chất rắn màu đen tím
ống nghiệm (3): dung dịch màu vàng nhạt dần và có chất rắn màu đen tím
2: Tính oxi hóa: Cl>Br
=>Cl đẩy Br- ra khỏi dung dịch muối
Tính oxi hóa; Br>I2
=>Br đẩy I- ra khỏi dung dịch muối
=>Tính oxi hóa; Cl2>Br2>I2
3: Để chứng tỏ có sự tạo thành I2 khi cho nước clo (hoặc nước brom) tác dụng với dung dịch sodium iốt ta có thể dùng thuốc thử là hồ tinh bột vì I2 tạo màu xanh đặc trưng với hồ tinh bột.

a) Phương trình hóa học của phản ứng
Na2CO3 + 2HNO3 → 2NaNO3 + CO2 + H2O
b) Thí nghiệm có thể xảy ra nên điều kiện phản ứng được thỏa mãn
=> Axit mới sinh ra H2CO3 yếu hơn HNO3 nên đã phân hủy thành khí CO2 và H2O

1: \(HCl+NaHCO_3\rightarrow NaCl+CO_2\uparrow+H_2O\)
2: Tính axit của HCl mạnh hơn H2CO3 vì HCl đẩy được H2CO3 ra khỏi dung dịch muối

- Lấy mỗi dung dịch một ít làm mẫu thử và đánh số thứ tự .
- Nhúng quỳ tím lần lượt vào từng dung dịch .
+, Mẫu thử nào làm quỳ tím hóa xanh là NaOH .
+, Mẫu thử nào làm quỳ tím hóa đỏ là HCl, HNO3 tạo thành nhóm (I) .
+, Những mẫu thử nào không làm quỳ tím chuyển màu là NaCl, NaBr, NaF, NaI tạo thành nhóm ( II ) .
- Cho dung dịch AgNO3 dư vào nhóm ( I ) .
+, Mẫu thử nào tan rồi tạo kết tủa trắng là HCl .
PTHH : \(AgNO_3+HCl\rightarrow AgCl+HNO_3\)
+, Mẫu thử nào không có hiện tượng gì là HNO3 .
- Cho dư dung dịch AgNO3 dư vào nhóm ( II ) .
+, Mẫu thử nào tan tạo kết tủa trắng là NaCl .
PTHH : \(AgNO_3+NaCl\rightarrow AgCl+HNO_3\)
+, Mẫu thử nào tan tạo kết tủa màu vàng là NaBr .
PTHH : \(AgNO_3+NaBr\rightarrow AgBr+HNO_3\)
+, Mẫu thử nào tan tạo kết tủa màu vàng nâu là NaF .
PTHH : \(AgNO_3+NaF\rightarrow AgF+HNO_3\)
+, Mẫu thử nào tan tạo kết tủa màu vàng là NaI .
PTHH : \(AgNO_3+NaI\rightarrow AgI+HNO_3\)

1: đầu tiên nước dd brom mất màu sau đó xuất hiện kết tủa trắng
SO\(_2\)2 + Br2 = H2SO4 + HBr
H2SO4 + BaCl = HCl + BaSO4(kết tủa)
2: xuất hiện khí mùi khai
NaOH + NH4HCO3 = NaHCO3 + NH3(khí) + H2O
3: xuất hiện khí không màu
Cu + H2SO4 = CuSO4 + SO2 + H2O \(\rightarrow\)

1.
* Thí nghiệm 1: Fe + CuSO4 → FeSO4 + Cu
Quá trình oxi hóa: Fe0 → Fe+2 + 2e
Quá trình khử: Cu+2 + 2e → Cu0
* Thí nghiệm 2: Fe + H2SO4 → FeSO4 + H2
Quá trình oxi hóa: Fe0 → Fe+2 + 2e
Quá trình khử: 2H+ + 2e → H20
2.
* Thí nghiệm 1:
- Chất oxi hóa CuSO4
- Chất khử Fe
* Thí nghiệm 2:
- Chất oxi hóa H2SO4
- Chất khử Fe

1.
Gọi a, b là mol NaBr, b là mol NaCl
\(\Rightarrow m=103a+58,5b\)
\(AgNO_3+NaBr\rightarrow AgBr+NaNO_3\)
\(AgNO_4+NaCl\rightarrow AgCl+NaNO_3\)
\(\Rightarrow m=199a+143,5b\)
\(\Rightarrow203a+58,5b=188a+143,5b\)
\(\Rightarrow85a=-85b\) (bạn xem lại đề)
2.
NaF ko tạo kết tủa
nNaCl= 0,04 mol = nAgCl
nNaBr= 0,01 mol = nAgBr
=> m= mAgCl+ mAgBr= 0,04.143,5+ 0,01.188= 7,62g
1: \(AgNO_3+NaI\rightarrow NaNO_3+AgI\downarrow\)
\(AgNO_3+NaCl\rightarrow NaNO_3+AgCl\downarrow\)
\(AgNO_3+NaBr\rightarrow NaNO_3+AgBr\downarrow\)
2: nếu xuất hiện kết tủa trắng thì ống nghiệm đó là NaCl
nếu xuất hiện kết tủa vàng nhạt thì ống nghiệm đó là NaBr
nếu xuất hiện kết tủa vàng đậm thì ống nghiệm đó là NaI
nếu ko xuất hiện kết tủa thì ống nghiệm đó là NaF