Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

TN1: A tác dụng với nước
Ba +2 H2O --> Ba(OH)2 + H2;
x ------------------x------------x ;
2Al + Ba(OH)2 +2 H2O --> Ba(AlO2)2 +3 H2;
2x--------x---------------------------------------3x;
TN2 : A tác dụng với dd xút
Ba +2 H2O --> Ba(OH)2 + H2;
x----------------------------------x;
2Al + Ba(OH)2 +2 H2O --> Ba(AlO2)2 +3 H2;
y-------------------------------------------------3/2y;
TN3: A tác dụng với HCl
Ba + 2HCl --> BaCl2 + H2;
x------------------------------x;
2Al + 6HCl --> 2AlCl3 + 3H2;
y------------------------------3/2y;
Mg + 2HCl --> MgCl2 + H2;
z------------------------------z;
Gọi x,y,z lần lượt là số mol của Ba, Al, Mg.
TN1: nH2= 3,36/22,4= 0,15 (mol)
=>x + 3x= 4x=0,15 => x= 0,0375 (mol)
TN2: nH2= 0,3 (mol)
=> x + 3/2 y = 0,3 => y = 0,175 (mol)
TN3: nH2= 0,4 (mol)
=> x +3/2y + z = 0,4 => Z= 0,1 (mol)
m= 0,0375*137+ 0,175*27+ 0,1*24=26,2625(g).

Gọi số mol của Ba, Al và Mg lần lượt là x, y và z mol
Lượng khí thu được khi cho A vào nước dư ít hơn khi cho A vào xút dư nên khi cho A vào nước dư thì Ba phản ứng hết, Al phản ứng một phần. Khi cho A vào xút dư thì cả Ba và Al đều phản ứng hết.
Cho A tác dụng với nước dư có phản ứng:
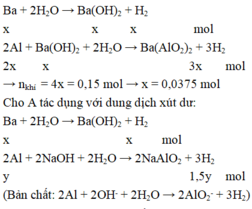

Khối lượng của A là: m = 0,0375.137 + 0,175.27 + 0,1.24 = 12,2625 gam.
⇒ Chọn B

Bài 1:
n H2=5.6/22.4=0.25(mol)
Zn + H2SO4  ZnSO4 + H2
ZnSO4 + H2
0.25 0.25
m Zn=0.25*65=16.25(g)
m hh=16.25+6.25=22.5(g)
% Zn=16.25/22.5*100%=72.22%
% Ag=100%-72.22%=27.78%
Bài 2:
-
nH2 = 6,72/22,4 = 0,3 mol
gọi x,y lần lượt là số mol của Mg và Zn tham gia phản ứng.
Mg + 2HCl MgCl2 + H2
MgCl2 + H2
x 2x x
Zn + 2HCl ZnCl2 + H2
ZnCl2 + H2
y 2y y
Ta có phương trình
x + y = 0,3
24x + 56y = 15,3
=> x = 0,102 ; y = 0.198
m Mg = 0,102.24 = 2,448 g
m Zn = 0,198.65 = 12.87 g
n HCl = 2.0,102+2.0,198 = 0,6 mol
V HCl = 0,6/1 = 0,6 lít.Bài 3:
TN1
n H2=3.36/22.4=0.15(mol)
Ba + 2H2O Ba(OH)2 + H2
Ba(OH)2 + H2
0.15 0.15
TN2
n H2 = 6.72/22.4=0.3(mol)
2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2
2NaAlO2 + 3H2
0.2 0.3
TN3
n H2=8.96/22.4=0.4(mol)
Ba + 2HCl BaCl2 + H2
BaCl2 + H2
0.15 0.15
2Al + 6HCl 2AlCl3 + 3H2
2AlCl3 + 3H2
0.2 0.2
Mg + 2HCl MgCl2 + H2
MgCl2 + H2
0.05 0.05
m Ba=0.15*137=20.55(g)
m Al=0.2*27=5.4(g)
m Mg=0.05*24=1.2(g)
m=20.55+5.4+1.2=27.15
%Ba=20.55/27.15*100%=75.69%
%Al=5.4/27.15*100%=19.89%
%Mg=100%-75.69%-19.89%=4.42%

TN1:Cho A t/d với H2O
Ba+ H2O -------> Ba(OH)2+ H2 (1)
a........a......................a.............a
Ba(OH)2+ 2Al + 2H2O-------> Ba(AlO2)2+ 3H2(2)
a................2a........2a.......................a..............3a
TN2:Cho A t/d với xút dư (NaOH) => Al hết
Ba+ 2H2O -----> Ba(OH)2+ H2(3)
a........2a...................a.............a
NaOH+ Al+ H2O ------> NaAlO2+ 3/2H2(4)
b...........b.......b.....................b............1.5b
TN3:Cho A t/d với HCl vừa đủ
Ba+ 2HCl -------> BaCl2+ H2(5)
a........2a...................a.........a
2Al+ 6HCl --------> 2AlCl3+ 3H2(6)
b..........3b.....................b.........1.5b
Mg+ 2HCl ---------> MgCl2+ H2(7)
c..........2c.......................c..........c
(Khi Al t/d với dd kiềm hoặc kiềm thổ thì nH2=3/2nAl
Nếu TN1 và TN2 Al p/ư vừa đủ thì VH2 ở 2 pt phải bằng nhau
Mà VH2(TN1)<VH2(TN2)=> Al ở TN1 dư=> tính theo Ba(OH)2
nH2(TN1)=0.15 mol
nH2(TN2)=0.3 mol
nH2(TN3)=0.55 mol
Đặt a, b, c là số mol Ba, Al, Mg
Khi đó theo pt(1)& (2) =>nH2=a+3a=0.15mol=>a=0.0375 (I)
Theo pt(3), (4) nH2=a+1.5b=0.3 (II)
Theo pt(5), (6), (7) nH2=a+1.5b+c=0.55 (III)
Giải hệ pt (I), (II), (III) =>a=0.0375 mol, b=0.175 mol, c=0.25 mol
=> m= 0.0375*137+0.175*27+0.25*24=15.8625 g
Do đó
%mBa=(0.0375*137*100)/15.8625=32.39%
%mAl=(0.175*27*100)/15.8625=29.79%
%mMg=37.82%

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

a/ Xác định kim loại M
nH2SO4 ban đầu = 78,4.6,25:100=0.05 mol
Goi số mol MO là a mol, mMO = (M+16).a
MO+H2SO4---MSO4+H2O(1)
a mol amol amol
Số mol axit dư sau phản ứng (1): 0,05-a mol
mdd sau phản ứng: (m+16)a+78,4
Theo bài ra ta có: 2,433=100.(0,05-a).98/[(m+16)a+78,4] (I)
Mặt khác: MO+CO---M+CO2 (2)
a mol a mol a mol amol
Theo bài ra CO2 tham gia phản ứng hết, các phản ứng có thể xảy ra:
CO2+2NaOH--->Na2CO3+H2O
b 2b b b
CO2+NaOH--->NaHCO3
c c c
Khối lượng muối tạo thành: 100b+84c=2,96
- Nếu NaOH dư không xảy ra phản ứng (3). Tức là c = 0 mol,
b = a = 2,96 : 106 = 0,028 mol. Thay a = 0,028 vào (I) ta tìm được M = 348,8 (loại).
- Nếu NaOH phản ứng hết: 2b + c = 0,5 . 0,1 = 0,05 (III)
Từ (II) và (III) ta có : 106 b + 84(0,05 – 2b) = 2,96
62b = 1,24 suy ra: b= 0,02 và c = 0,01
Theo 2, 3 và 4, n co2 = 0,03= n MO = a = 0,03.
Thay giá trị a = 0,03 và (I) ta có: 0,07299M = 4,085
M = 56 vậy kim loại M là Fe, mMO=(56+16).0,03= 2,16 g
b/ Dung dịch E gồm FeSO4 0,03 mol và H2SO4 dư 0,02 mol. Khi cho Al phản ứng hoàn toàn tạo 1,12 gam chất rắn, H2SO4 phản ứng hết.
2Al+3H2SO4---->Al2(SO4)3+3H2
2Al+3FeSO4----->Al2(SO4)3+3Fe
Khối lượng Fe trong dung dịch E : 56 . 0,03 = 1,68 gam > 1,12 gam
Như vậy FeSO4 còn dư thì Al tan hết. Vây t = 1,12: 56 =0,02 mol
Vây n Al = 0,04 : 3 + 0,04:3 = (0,08 : 3) mol
Vây khối lượng x = 0,08: 3 . 27 = 0,72 gam

Gọi số mol trong mỗi phần: Fe = x mol; M = y mol.
Phần 1:
Fe + 2HCl FeCl2 + H2
(mol): x x
2M + 2nHCl 2MCln + nH2
(mol): y 0,5ny
Số mol H2 = 0,07 nên x + 0,5ny = 0,07.
Phần 2:
2Fe + 6H2SO4 (đặc) Fe2(SO4)3 + 3SO2 + 6H2O
(mol): x 1,5x
2M + 2nH2SO4 (đặc) M2(SO4)n + nSO2 + 2nH2O
(mol): y 0,5nx
Số mol SO2 = 0,09 nên 1,5x + 0,5ny = 0,09. Vậy x = 0,04 và ny = 0,06.
Mặt khác: 56x + My = 2,78 nên My = 0,54. Vậy hay M = 9n.
Ta lập bảng sau:
| n | 1 | 2 | 3 |
| M | 9 ( loại ) | 18 ( loại ) | 27 ( nhận ) |
Vậy M là \(Al\) ( nhôm ) .
Đặt a là số mol Fe, b là số mol của M,trong mỗi phần,n là hóa trị của M
PTHH: Fe +2HCl ---> FeCl2 + H2
a a
2M + 2n HCl ---> 2 MCln + n H2
b bn/2
n H2= 0.07
---> a + bn/2 = 0.07 (1)
m hh A = 56a + Mb = 2.78 (2)
PTHH: Fe + 4HNO3 ----> Fe(NO3)3 + NO + 2H2O
a a
3M +4n HNO3 ---->3M(NO3)n +nNO + 2n H2O
b bn/3
n NO = a + bn/3 = 0.06 (3)
Từ (1) và (3) giải hệ ta dc : a= 0.04
bn = 0.06---> b= 0.06/n (4)
Thế à= 0.04vào pt (2) giải ra ta đc : 2.24 + Mb = 2.78
-----> b = 0.54/ M (5)
Từ (4) và (5) ----> M= 9n
Biện luận n
n=1 ----> M = 9 (loại)
n=2 ----> M= 18 (loại)
n=3-----> M=27 (nhận)
Do đó : M là Al

mol H2=0,4 →mol HCl=0,8 Áp dụng BTKL:mhh+mhcl=mmuối+mh2 →mmuối=35,4g
\(A\)tác dụng với nước
\(Ba+2H2O\Leftrightarrow Ba\left(OH\right)2+H2\)
\(2Al+Ba\left(OH\right)2+2H2O\Leftrightarrow Ba\left(AlO2\right)2+3H\)
\(Ba+2H2O\Leftrightarrow Ba\left(OH\right)2+H2\)
\(2Al+Ba\left(OH\right)2+2H2O\Leftrightarrow Ba\left(AlO2\right)2+3H\)
\(A\)tác dụng với \(HCl\)
\(Ba+2HCl\Leftrightarrow BaCl2+H2\)
\(2Al+6HCl\Leftrightarrow2AlCl3+3H2\)
\(Mg+2HCl\Leftrightarrow MgCl2+H2\)
Gọi \(x,y,z\)lần lượt là số \(mol\)của \(Ba,Al,Mg\)
\(nH2=\frac{3,36}{22,4}=0,15mol\)
\(\Rightarrow x+3x=4x=0,15\Rightarrow x=0,0375mol\)
\(nH2=0,3mol\)
\(\Rightarrow x+\frac{3}{2y}=0,3\Rightarrow y=0,175mol\)
\(nH2=0,4mol\)
\(\Rightarrow x+\frac{3}{2y}+z=0,4\Rightarrow z=0,1mol\)
\(m=0,0375.137+0,175.27=0,1.24=26,2625g\)
@Hoàng_Tuấn