
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

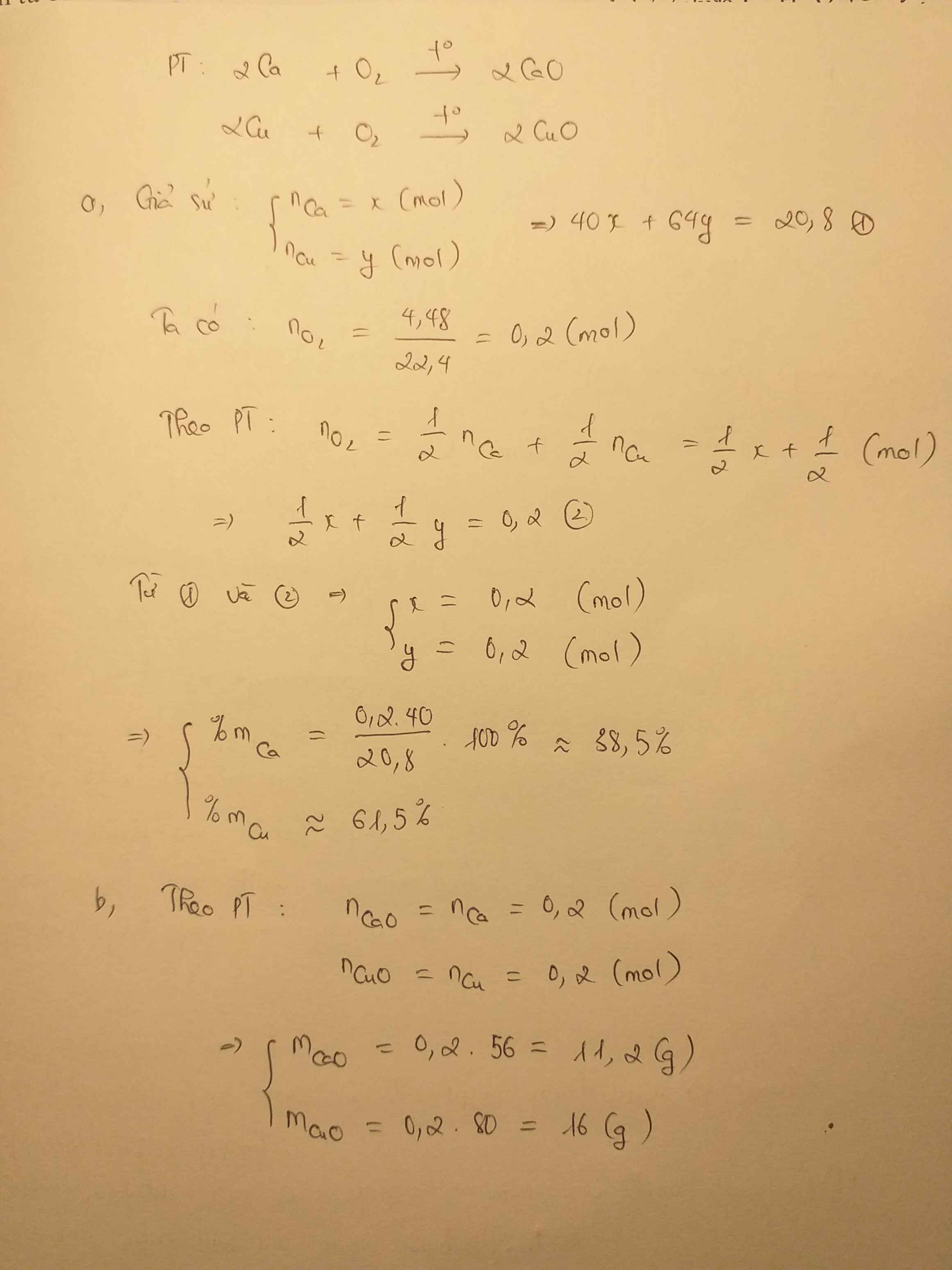

a)
Dung dịch X gồm $Ca(OH)_2,Ba(OH)_2$ làm đổi màu quỳ tím chuyển màu xanh.
b)
$Ca + 2H_2O \to Ca(OH)_2 + H_2$
$Ba + 2H_2O \to Ba(OH)_2 + H_2$
Gọi $n_{Ca} = a ; n_{Ba} = b$
Ta có :
$m_{hh} = 40a + 137b = 17,7(gam)$
$n_{H_2} = a + b = 0,2(mol)$
Suy ra a = b = 0,1
$\%m_{Ca} = \dfrac{0,1.40}{17,7}.100\% = 22,6\%$
$\%m_{Ba} = 100\%-22,6\% = 77,4\%$
c)
$n_{Ca(OH)_2} = n_{Ba(OH)_2} = a = b = 0,1(mol)$
$m_{Ca(OH)_2} = 0,1.74 = 7,4(gam)$
$m_{Ba(OH)_2} = 0,1.171 = 17,1(gam)$

\(n_{hh}=\frac{V}{22,4}=\frac{4,48}{22,4}=0,2\left(mol\right)\)
\(n_{CaCO_3}=\frac{m}{M}=\frac{30}{100}=0,3\left(mol\right)\)
Gọi x là số mol Ch4 ; y là số mol C2H6
\(CH_4+2O_2\rightarrow CO_2+2H_2O\)
x x
\(C_2H_6+\frac{7}{2}O_2\rightarrow2CO_2+3H_2O\)
y 2y
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
0,3 0,3
Ta có hê phương trình
\(\hept{\begin{cases}x+y=0,2\\x+2y=0,3\end{cases}}\)
\(\Rightarrow\hept{\begin{cases}x=0,1\left(mol\right)\\y=0,1\left(mol\right)\end{cases}}\)
Vì Số mol hai chất bằng nhau nên thể tích hai chất cũng bằng nhau nên phần trăm thể tích mỗi chất là 50%

\(a,n_{H_2}=\dfrac{4,48}{22,4}=0,2mol\\
Fe+2HCl\rightarrow FeCl_2+H_2\\
n_{Fe}=n_{H_2}=0,2mol\\
m_{Fe}=0,2.56=11,2g\\
m_{Cu}=25-11,2=13,8g\\
b,\%m_{Fe}=\dfrac{11,2}{25}\cdot100=44,8\%\\
\%m_{Cu}=100-44,8=55,2\%\)
c, Gọi CTHH của sắt là \(Fe_xO_y\)
\(Fe_xO_y+yH_2\xrightarrow[t^0]{}xFe+yH_2O\\ \Rightarrow n_{Fe_xO_y}=n_{H_2}:y\\ \Leftrightarrow\dfrac{11,6}{56x+16y}=\dfrac{0,2}{y}\\ \Leftrightarrow11,6y=11,2x+3,2y\\ \Leftrightarrow11,6y-3,2y=11,2x\\ \Leftrightarrow8,4y=11,2x\\ \Leftrightarrow\dfrac{x}{y}=\dfrac{8,4}{11,2}=\dfrac{3}{4}\\ \Rightarrow x=3;y=4\\ \Rightarrow CTHH:Fe_3O_4\)

a) Fe+ H2SO4 ---> FeSo4 + H2
b)
nH2 = 4,48 : 22,4 =0,2 mol
Fe+ H2SO4 ---> FeSO4 + H2
0,2mol--0,2mol ---- 0,2mol--0,2mol
=> mFe = 0,2 .56 = 11,2 g
=> mCu = 14,3 = 11,2 = 3,1 g
c)
khối lượng của dd muối FeSO4 tạo thành là:
mdd FeSO4 =150+ mFe - mH2 = 150 + 0,2.56 - 0,2 .2 = 160,8 g
mFeSO4 = 0,2 .152=30,4 g
C% dd FeSO4 = mFeSO4.100%/ mdd FeSO4
= 30,4.100%/160,8 = 18,9 %
a, \(PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Theo PT:__1___1__________1_________1
Theo đề : 0,2________________0,2___0,2
\(Cu+H_2SO_4\underrightarrow{\times}\)
b, \(\%m_{Fe}=\frac{0,2.56}{14,3}.100\%=78,32\%\)
c, \(C\%_{FeSO4}=\frac{0,2.152}{14,3.150-0,2.2}.100\%=18,55\%\)

a) PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
b) \(n_{H_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
_____0,02<---0,03<---------------------0,03
=> \(\left\{{}\begin{matrix}\%Al=\dfrac{0,02.27}{2,16}.100\%=25\%\\\%Cu=100\%-25\%=75\%\end{matrix}\right.\)
c) mH2SO4 = 0,03.98 = 2,94 (g)
=> \(C\%\left(H_2SO_4\right)=\dfrac{2,94}{200}.100\%=1,47\%\)

Gọi hóa trị của R là n
Số mol của Fe, R trong từng phần là 3a, 2a
Phần 2:
Ta có :
\(\text{nH2 = 26,88 : 22,4 = 1,2 mol}\)
\(\text{Fe + 2HCl → FeCl2 + H2↑}\)
3a......................................3a.......(mol)
\(\text{2R + 2nHCl → 2RCln + nH2↑}\)
2a............................................na.............(mol)
\(\text{nH2 = 3a + na = 1,2 mol (1)}\)
Phần 3:
\(\text{nCl2 = 33,6 : 22,4 = 1,5 mol}\)
\(\text{2Fe + 3Cl2 → 2FeCl3}\)
3a.........4,5a.......................(mol)
\(\text{2R + nCl2 → 2RCln }\)
2a.........an.....................(mol)
\(\text{nCl2 = 4,5a + an = 1,5 mol (2)}\)
Từ (1) và (2) → a = 0,2; an = 0,6
→ n = 3
Phần 1:
\(\text{nFe = 0,6mol; nR = 0,4 mol}\)
\(\text{3Fe + 2O2 → Fe3O4}\)
0,6.......................0,2.............(mol)
\(\text{4R + 3O2 → 2R2O3}\)
0,4...................0,2..................(mol)
\(\text{mFe3O4 + mR2O3 = 66,8}\)
→ 0,2 . 232 + 0,2 . (2.MR + 48) = 66,8
→ MR = 27
→ R là nhôm
Trong hỗn hợp A có:
\(\text{mFe = 0,6 . 56 . 3 = 100,8(g)}\)
\(\text{mAl = 0,4 . 27 . 3 = 32,4(g)}\)