Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(n_S=\dfrac{16}{32}=0,5\left(mol\right)\)
PTHH: S + O2 --to--> SO2
0,5->0,5------>0,5
=> mSO2 = 0,5.64 = 32 (g)
b) VO2 = 0,5.22,4 = 11,2 (l)
=> Vkk = 11,2.5 = 56 (l)
c)
\(n_{O_2}=\dfrac{24}{32}=0,75\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,5}{1}< \dfrac{0,75}{1}\)
=> S hết, O2 dư
PTHH: S + O2 --to--> SO2
0,5->0,5------>0,5
=> nO2(dư) = 0,75 - 0,5 = 0,25 (mol)

Bài 3 :
- PTHH : \(S+O_2\left(t^o\right)->SO_2\) (1)
- PƯ trên thuộc loại PƯ cháy vì ta phải đốt lưu huỳnh nên có sự cháy giữa lưu huỳnh và oxi
- Ta có : \(n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\)
Từ (1) -> \(n_{O_2}=n_S=0,2\left(mol\right)\)
=> \(V_{O_2\left(đktc\right)}=n.22,4=0,2.22,4=4,48\left(l\right)\)
Bài 4 :
- PTHH : \(3Fe+2O_2\left(t^o\right)->Fe_3O_4\) (2)
\(n_{Fe}=\dfrac{m}{M}=\dfrac{42}{56}=0,75\left(mol\right)\)
Từ (2) -> \(n_{O_2}=\dfrac{2}{3}n_{Fe}=0,5\left(mol\right)\)
=> \(V_{O_2\left(đktc\right)}=n.22,4=0,5.22,4=11,2\left(l\right)\)
Từ (2) -> \(n_{Fe_2O_3}=\dfrac{1}{3}n_{Fe}=0,25\left(mol\right)\)
=> \(m_{Fe_2O_3}=n.M=0,25.\left(56.2+16.3\right)=40\left(g\right)\)

\(n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\)
PTHH: S + O2 --to--> SO2
0,2->0,2---->0,2
Pư trên thuộc loại pư hóa hợp do từ 2 chất là S, O2 ban đầu tạo ra 1 chất là SO2
VO2 = 0,2.22,4 = 4,48 (l)

a) Phương trình phản ứng hóa học :
S + O2 \(\rightarrow\) SO2
b) Số mol lưu huỳnh tham gia phản ứng :
\(n_S=\frac{3,2}{32}=0,1\left(mol\right)\)
Theo phương trình, ta có : nSO2 = nS = nO2 = 0,1 mol
=> Thể tích khí sunfurơ sinh ra ở đktc là :
\(V_{SO_2}=22,4.0,1=2,24\left(l\right)\)
Tương tự thể tích khí oxi cần dùng ở đktc là :
\(V_{O_2}=22,4.0,1=2,24\left(l\right)\)
Vì khí oxi chiếm 20% thể tích của không khí nên thể tích không khí cần là :
\(V_{kk}=5.V_{O_2}=5.2,24=11,2\left(l\right)\)
Nếu thế số vào phương trình thì là :
Ta có phương trình hóa học :
S + O2 \(\rightarrow\) SO2
1mol 1mol 1mol
0,1 0,1 0,1

\(n_S=\dfrac{9,6}{32}=0,3\left(mol\right)\\
pthh:S+O_2\underrightarrow{t^o}SO_2\)
0,3 0,3 0,3
\(m_{SO_2}=0,3.64=19,2\left(g\right)\\
V_{KK}=\left(0,3.22,4\right):\dfrac{1}{5}=33,6\left(L\right)\)
\(n_S=\dfrac{9,6}{32}=0,3\left(mol\right)\)
PTHH: S + O2 --to--> SO2
0,3-->0,3----->0,3
\(\rightarrow\left\{{}\begin{matrix}m_{SO_2}=0,3.64=19,2\left(g\right)\\V_{kk}=0,3.5.22,4=33,6\left(l\right)\end{matrix}\right.\)

\(S+O2-->SO2\)
a) \(n_{SO2}=\frac{6,4}{64}=0,1\left(mol\right)\)
\(nO2=n_{SO2}=0,1\left(mol\right)\)
\(V_{O2}=0,1.22,4=2,24\left(l\right)\)
b) \(2KClO3-->2KCl+3O2\)
\(nKClO3=\frac{2}{3}n_{O2}=\frac{1}{15}\left(mol\right)\)
\(mKClO3=\frac{1}{15}.122,5=\frac{49}{6}\left(g\right)\)

a) PTHH : \(S+O_2->SO_2\)
b) Ta có : \(n_S\) = \(\dfrac{m_S}{M_S}\) = 0.1 (mol)
Có : \(n_S=n_{O_2}\)
--> \(n_{O_2}\) = 0.1 (mol)
=> \(V_{O_2\left(đktc\right)}\) = \(n_{O_2}\) . 22.4 = 2.24 (L)
\(n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\\ PTHH:S+O_2\underrightarrow{t^o}SO_2\\ \left(mol\right)..0,1\rightarrow0,1..0,1\\ V_{O_2}=0,1.22,4=2,24\left(l\right)\)

S+O2-to>SO2
0,2--0,2----0,2 mol
n SO2=\(\dfrac{4,48}{22,4}\)=0,2 mol
=>m S=0,2.32=6,4g
=>VO2=0,2.22,4=4,48l

\(1,2H_2+O_2\underrightarrow{t}2H_2O\)
\(2Mg+O_2\underrightarrow{t}2MgO\)
\(2Cu+O_2\underrightarrow{t}2CuO\)
\(S+O_2\underrightarrow{t}SO_2\)
\(4Al+3O_2\underrightarrow{t}2Al_2O_3\)
\(C+O_2\underrightarrow{t}CO_2\)
\(4P+5O_2\underrightarrow{t}2P_2O_5\)
\(2,PTHH:C+O_2\underrightarrow{t}CO_2\)
\(a,n_{O_2}=0,2\left(mol\right)\Rightarrow n_{CO_2}=0,2\left(mol\right)\Rightarrow m_{CO_2}=8,8\left(g\right)\)
\(b,n_C=0,3\left(mol\right)\Rightarrow n_{CO_2}=0,3\left(mol\right)\Rightarrow m_{CO_2}=13,2\left(g\right)\)
c, Vì\(\frac{0,3}{1}>\frac{0,2}{1}\)nên C phản ửng dư, O2 phản ứng hết, Bài toán tính theo O2
\(n_{O_2}=0,2\left(mol\right)\Rightarrow n_{CO_2}=0,2\left(mol\right)\Rightarrow m_{CO_2}=8,8\left(g\right)\)
\(3,PTHH:CH_4+2O_2\underrightarrow{t}CO_2+2H_2O\)
\(C_2H_2+\frac{5}{2}O_2\underrightarrow{t}2CO_2+H_2O\)
\(C_2H_6O+3O_2\underrightarrow{t}2CO_2+3H_2O\)
\(4,a,PTHH:4P+5O_2\underrightarrow{t}2P_2O_5\)
\(n_P=1,5\left(mol\right)\Rightarrow n_{O_2}=1,2\left(mol\right)\Rightarrow m_{O_2}=38,4\left(g\right)\)
\(b,PTHH:C+O_2\underrightarrow{t}CO_2\)
\(n_C=2,5\left(mol\right)\Rightarrow n_{O_2}=2,5\left(mol\right)\Rightarrow m_{O_2}=80\left(g\right)\)
\(c,PTHH:4Al+3O_2\underrightarrow{t}2Al_2O_3\)
\(n_{Al}=2,5\left(mol\right)\Rightarrow n_{O_2}=1,875\left(mol\right)\Rightarrow m_{O_2}=60\left(g\right)\)
\(d,PTHH:2H_2+O_2\underrightarrow{t}2H_2O\)
\(TH_1:\left(đktc\right)n_{H_2}=1,5\left(mol\right)\Rightarrow n_{O_2}=0,75\left(mol\right)\Rightarrow m_{O_2}=24\left(g\right)\)
\(TH_2:\left(đkt\right)n_{H_2}=1,4\left(mol\right)\Rightarrow n_{O_2}=0,7\left(mol\right)\Rightarrow m_{O_2}=22,4\left(g\right)\)
\(5,PTHH:S+O_2\underrightarrow{t}SO_2\)
\(n_{O_2}=0,46875\left(mol\right)\)
\(n_{SO_2}=0,3\left(mol\right)\)
Vì\(0,46875>0,3\left(n_{O_2}>n_{SO_2}\right)\)nên S phản ứng hết, bài toán tính theo S.
\(a,\Rightarrow n_S=n_{SO_2}=0,3\left(mol\right)\Rightarrow m_S=9,6\left(g\right)\)
\(n_{O_2}\left(dư\right)=0,16875\left(mol\right)\Rightarrow m_{O_2}\left(dư\right)=5,4\left(g\right)\)
\(6,a,PTHH:C+O_2\underrightarrow{t}CO_2\)
\(n_{O_2}=1,5\left(mol\right)\Rightarrow n_C=1,5\left(mol\right)\Rightarrow m_C=18\left(g\right)\)
\(b,PTHH:2H_2+O_2\underrightarrow{t}2H_2O\)
\(n_{O_2}=1,5\left(mol\right)\Rightarrow n_{H_2}=0,75\left(mol\right)\Rightarrow m_{H_2}=1,5\left(g\right)\)
\(c,PTHH:S+O_2\underrightarrow{t}SO_2\)
\(n_{O_2}=1,5\left(mol\right)\Rightarrow n_S=1,5\left(mol\right)\Rightarrow m_S=48\left(g\right)\)
\(d,PTHH:4P+5O_2\underrightarrow{t}2P_2O_5\)
\(n_{O_2}=1,5\left(mol\right)\Rightarrow n_P=1,2\left(mol\right)\Rightarrow m_P=37,2\left(g\right)\)
\(7,n_{O_2}=5\left(mol\right)\Rightarrow V_{O_2}=112\left(l\right)\left(đktc\right)\);\(V_{O_2}=120\left(l\right)\left(đkt\right)\)
\(8,PTHH:C+O_2\underrightarrow{t}CO_2\)
\(m_C=0,96\left(kg\right)\Rightarrow n_C=0,08\left(kmol\right)=80\left(mol\right)\Rightarrow n_{O_2}=80\left(mol\right)\Rightarrow V_{O_2}=1792\left(l\right)\)
\(9,n_p=0,2\left(mol\right);n_{O_2}=0,3\left(mol\right)\)
\(PTHH:4P+5O_2\underrightarrow{t}2P_2O_5\)
Vì\(\frac{0,2}{4}< \frac{0,3}{5}\)nên P hết O2 dư, bài toán tính theo P.
\(a,n_{O_2}\left(dư\right)=0,05\left(mol\right)\Rightarrow m_{O_2}\left(dư\right)=1,6\left(g\right)\)
\(b,n_{P_2O_5}=0,1\left(mol\right)\Rightarrow m_{P_2O_5}=14,2\left(g\right)\)
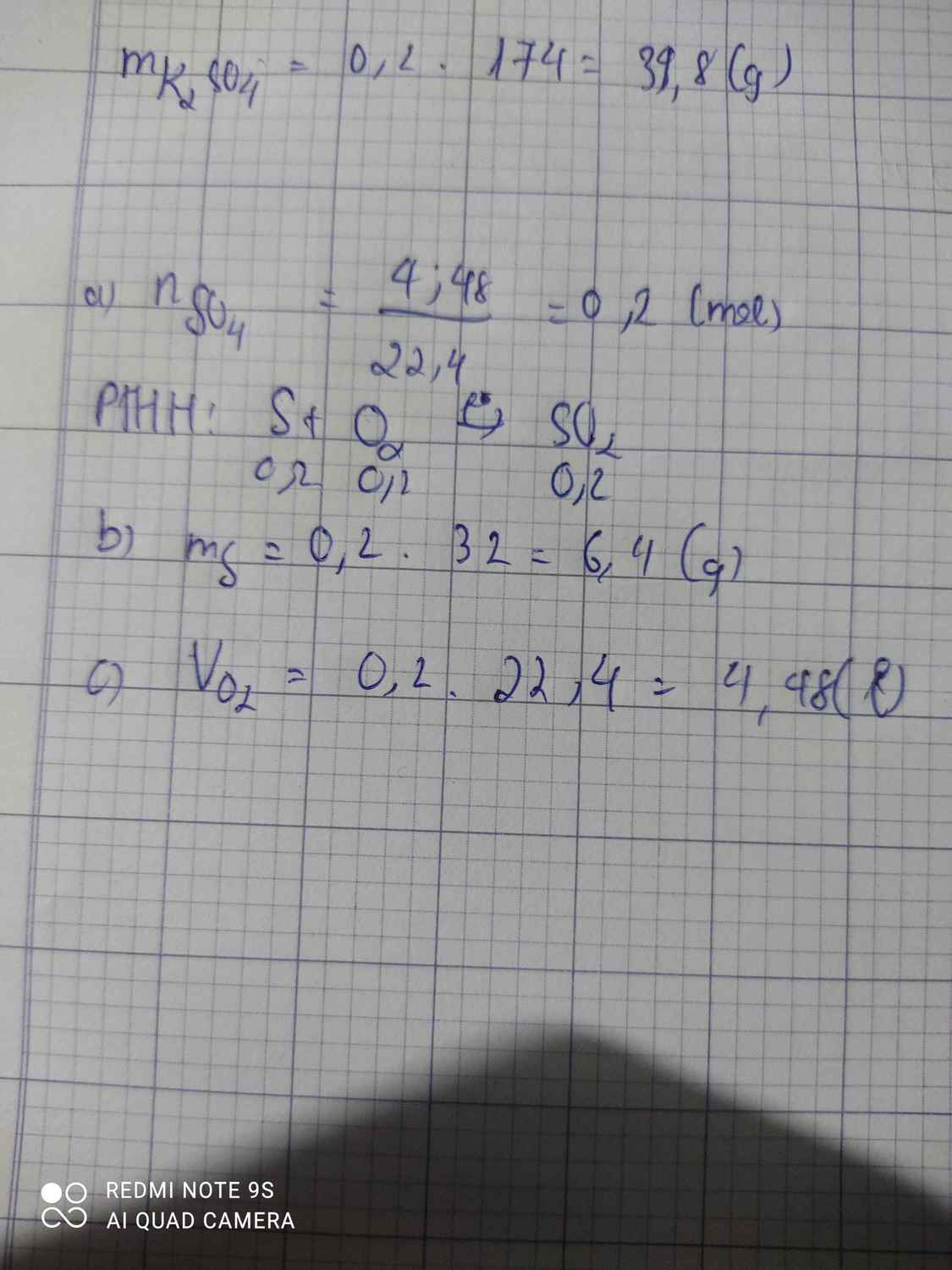
a, PTHH ( I ) : \(S+O_2\rightarrow SO_2\)
b, \(n_S=\frac{m_S}{M_S}=\frac{4,8}{32}=0,15\left(mol\right)\)
- Theo PTHH ( I ): \(n_{SO_2}=n_S=0,15\left(mol\right)\)
-> \(m_{SO_2}=n.M=0,15.\left(32+16.2\right)=0,15.64=9,6\left(g\right)\)
c, Theo PTHH ( I ): \(n_{O_2}=n_S=0,15\left(mol\right)\)
-> \(V_{O_2}=n_{O_2}.22,4=0,15.22,4=3,36\left(l\right)\)
d, PTHH ( II ): \(2KClO_3\rightarrow2KCl+3O_2\)
- Theo PTHH ( II ) : \(n_{KClO_3}=\frac{2}{3}n_{O_2}=\frac{2}{3}.0,15=0,1\left(mol\right)\)
-> \(m_{KClO_3}=n.M=0,15.\left(39+35,5+16.3\right)=18,375\left(g\right)\)
Vậy khối lượng KClO3 là : \(\frac{18,375.100}{85}=26,1\left(g\right)\)
a, PTHH : S+O2→SO2
b, nS=4,8\32=0,15(mol)
- Theo PTHH : nSO2=nS=0,15(mol)
-> mSO2=0,15.(32+16.2)=0,15.64=9,6(g)
c, Theo PTHH : nO2=nS=0,15(mol)
-> VO2=0,15.22,4=3,36(l
d, PTHH : 2KClO3→2KCl+3O2
- Theo PTHH : nKClO3==23.0,15=0,1(mol)
-> mKClO3=n.M=0,15.(39+35,5+16.3)=18,375(g)
Vậy khối lượng KClO3 là : 18,375.100\85=26,1(g)