Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(2Cu+O_2\underrightarrow{t^o}2CuO\)
Ta có: \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)=n_{Cu\left(p/ư\right)}\)
\(\Rightarrow n_{Cu\left(dư\right)}=\dfrac{12,8}{64}-0,15=0,05\left(mol\right)\)
\(\Rightarrow n_{O_2\left(cầnthêm\right)}=0,025mol\) \(\Rightarrow V_{O_2\left(thêm\right)}=0,025\cdot22,4=0,56\left(l\right)\)
\(n_{Cu} = \dfrac{12,8}{64} = 0,2(mol)\\ n_{CuO} = \dfrac{12}{80} = 0,15(mol)\\ 2Cu + O_2 \xrightarrow{t^o} 2CuO\)
Ta thấy : nCu = 0,2 > nCuO = 0,15 nên Cu dư.
Theo PTHH : \(n_{O_2\ } = \dfrac{1}{2}n_{CuO} = 0,075(mol)\)
Nếu đốt cháy hết lượng Cu ban đầu thì cần \(n_{O_2} = \dfrac{1}{2}n_{Cu} = 0,1(mol)\)
Suy ra :
\(n_{O_2\ cần\ thêm} = 0,1 - 0,075 = 0,025(mol)\\ \Rightarrow V_{O_2} = 0,025.22,4 = 0,56(lít)\)

nS = 1,92/32 = 0,06 (mol)
PTHH: S + O2 -> (t°) SO2
Mol: 0,06 ---> 0,06 ---> 0,06
VSO2 (LT) = 0,06 . 22,4 = 1,344 (l)
VSO2 (TT) = 1,344 . 90% = 1,2096 (l)

\(n_{Cu}=\dfrac{51,2}{64}=0,8\left(mol\right)\\ PTHH:2Cu+O_2\underrightarrow{t^o}2CuO\\ \left(mol\right)....0,8\rightarrow..0,4.....0,8\\ m_{CuO}=0,8.80=64\left(g\right)\)

a) \(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
PTHH: \(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
0,2--->0,2---->0,2
\(\Rightarrow m_{Cu}=0,2.64=12,8\left(g\right)\)
b) \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
c) \(2H_2+O_2\xrightarrow[]{t^o}2H_2O\)
0,2--->0,1
\(\Rightarrow V_{O_2}=0,1.22,4=2,24\left(l\right)\)
a: CuO+H2->Cu+H2O
0,2 0,2 0,2 0,2
mCu=0,2*64=12,8(g)
b: V=0,2*22,4=4,48(lít)

Gọi x, y lần lượt là số mol của Cu và Fe.
Ta có: \(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
a. PTHH: 2Cu + O2 ---to---> 2CuO (1)
3Fe + 2O2 ---to---> Fe3O4 (2)
Ta có: \(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
Theo PT(1): \(n_{Cu}=n_{CuO}=0,2\left(mol\right)\)
Theo PT(1): \(n_{O_2}=\dfrac{1}{2}.n_{Cu}=\dfrac{1}{2}x\left(mol\right)\)
Theo PT(2): \(n_{O_2}=\dfrac{2}{3}.n_{Fe}=\dfrac{2}{3}y\left(mol\right)\)
=> \(\dfrac{1}{2}x+\dfrac{2}{3}y=0,3\)
Mà nCu = 0,2(mol)
Thay vào, ta được: \(\dfrac{1}{2}.0,2+\dfrac{2}{3}y=0,3\)
=> y = 0,3(mol)
=> \(m_{Cu}=0,2.64=12,8\left(g\right)\)
\(m_{Fe}=0,3.56=16,8\left(g\right)\)
b. \(\%_{Cu}=\dfrac{12,8}{12,8+16,8}.100\%=43,24\%\)
\(\%_{Fe}=100\%-43,24\%=56,76\%\)

\(n_{KMnO_4}=\dfrac{63,2}{158}=0,4\left(mol\right)\\
pthh:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
0,4 0,2
=> \(V_{O_2\left(lt\right)}=0,2.22,4=4,48\left(l\right)\\
V_{O_2\left(tt\right)}=\dfrac{90.4,48}{100}=4,032\left(l\right)\)

PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Ta có: \(n_{KMnO_4}=\dfrac{31,6}{158}=0,2\left(mol\right)\)
Theo PT: \(n_{O_2\left(LT\right)}=\dfrac{1}{2}n_{KMnO_4}=0,1\left(mol\right)\)
Mà: H% = 80%
\(\Rightarrow n_{O_2\left(TT\right)}=0,1.80\%=0,08\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,08.22,4=1,792\left(l\right)\)
PT: \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
Ta có: \(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,1}{4}>\dfrac{0,08}{5}\), ta được P dư.
Theo PT: \(n_{P\left(pư\right)}=\dfrac{4}{5}n_{O_2}=0,064\left(mol\right)\)
\(\Rightarrow n_{P\left(dư\right)}=0,1-0,064=0,036\left(mol\right)\)
\(\Rightarrow m_{P\left(dư\right)}=0,036.31=1,116\left(g\right)\)
Bạn tham khảo nhé!
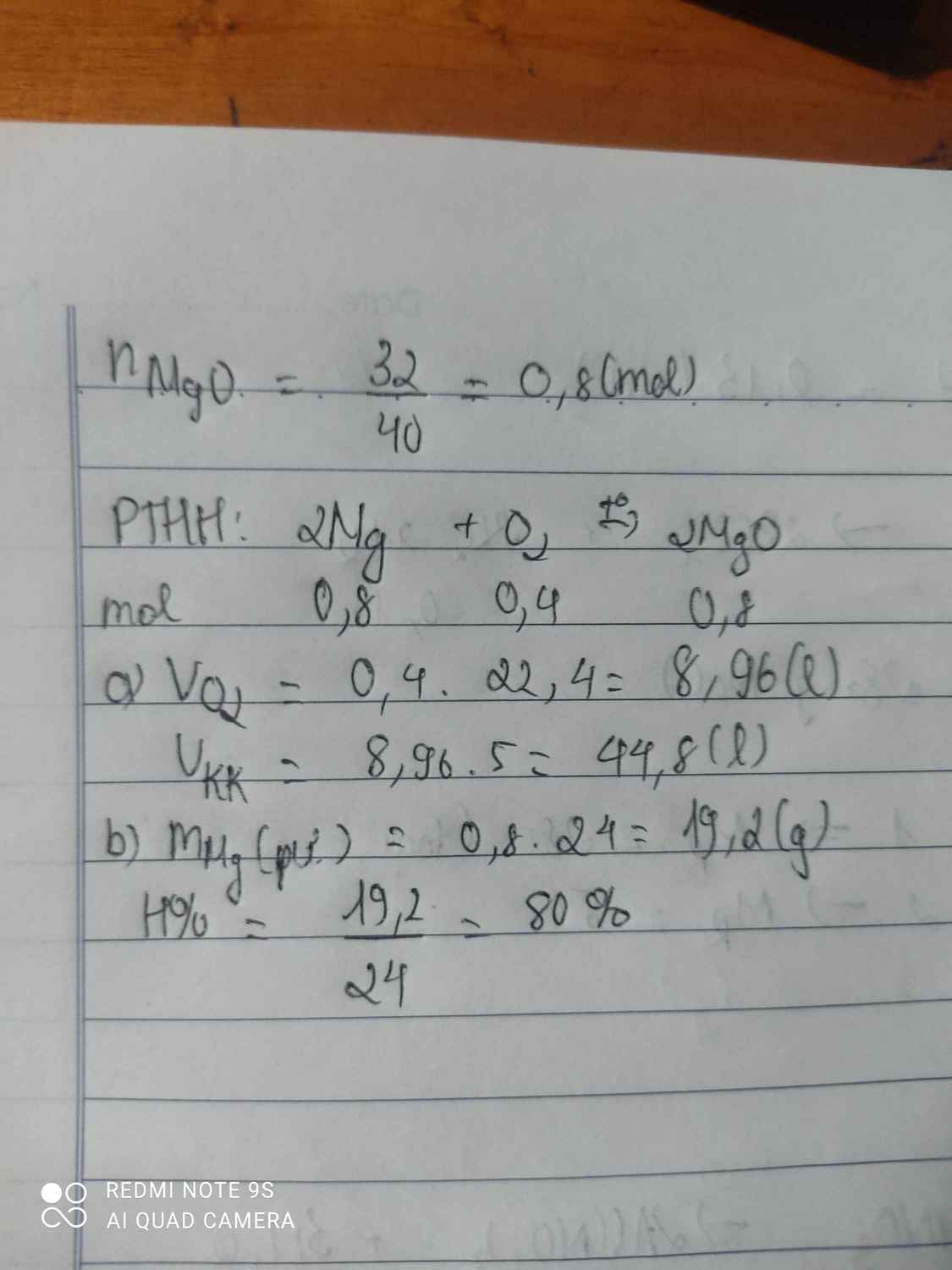
\(a) 2Cu + O_2 \xrightarrow{t^o} 2CuO\\ n_{Cu} = \dfrac{51,2}{64} = 0,8(mol)\\ n_{O_2} = \dfrac{1}{2}n_{Cu} = 0,4(mol) \Rightarrow V_{O_2} = 0,4.22,4 = 8,96(lít)\\ b) n_{Cu\ pư} = n_{CuO} = \dfrac{48}{80} = 0,6(mol)\\ \Rightarrow H = \dfrac{0,6}{0,8}.100\% = 75\%\)