Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vậy O 2 dư.
Sau phản ứng Na không dư nên không có khí H 2 bay ra, quỳ tím chuyển sang màu xanh vì:
N a 2 O + H 2 O → 2 N a O H

a. 2Na + 2H2O ➜ 2NaOH + H2 (1)
2K + 2H2O ➜ 2KOH + H2 (2)
b. nNa=0,2mol; nK=0,1 mol
➜ nH2(1)=0,1 mol; nH2(2)=0,05 mol
ΣnH2=0,15 mol
VH2= 0,15x22,4=3,36 l
c. Dung dịch sao phản ứng làm quỳ tím đổi màu thành xanh vì sản phẩm sau phản ứng là Bazơ

Na+H2O-------->NaOH+1/2H2
K+H2O------->KOH+1/2H2
nNa=4,6/23=0,2
nK=3,9/39=0,1mol
Na------>Na+ +1e
0,2---------------0,2mol
K--------->K+ +1e
0,1---------------0,1mol
2H+ +2e-------->H2
x-------2xmol-----0,5x
theo đlbte:2x=0,1+0,2
---->x=0,15
nH2=0,15*0,5=0,075mol
Vh2=0,075*22,4=1,68lít
c,Dung dịch sau phản ứng làm quỳ tím chuyển sang màu xanh

CaCO3 + 2HCl -> CaCl2 + CO2 + H2O (1)
2NaOH + CO2 -> Na2CO3 + H2O (2)
nCaCO3=0,15(mol)
nHCl=0,2(mol)
Vì \(\dfrac{0,2}{2}< 0,15\) nên CaCO3 dư
Theo PTHH 1 ta có:
nCO2=\(\dfrac{1}{2}\)nHCl=0,1(mol)
Theo PTHH 2 ta có:
nCO2=nNa2CO3=0,1(mol)
mNa2CO3=106.0,1=10,6(g)

1/ Ta có: \(n_{HCl}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Giả sử hỗn hợp chỉ có Mg:
\(\Rightarrow n_{Mg}=\dfrac{3,84}{24}=0,16\left(mol\right)\)
\(\Rightarrow n_{HCl}=2.0,16=0,32\left(mol\right)< 0,6\left(1\right)\)
Giả sử hỗn hợp chỉ có Al:
\(\Rightarrow n_{Al}=\dfrac{3,84}{27}=\dfrac{32}{225}\left(mol\right)\)
\(\Rightarrow n_{HCl}=\dfrac{32}{225}.3=0,427< 0,6\left(2\right)\)
Từ (1) và (2) suy ra kim loại phản ứng hết axit dư.
b/ \(Mg\left(x\right)+2HCl\rightarrow MgCl_2+H_2\left(x\right)\)
\(2Al\left(y\right)+6HCl\rightarrow2AlCl_3+3H_2\left(1,5y\right)\)
Gọi số mol của Mg và Al lần lược là x, y thì ta có:
\(24x+27y=3,84\left(3\right)\)
\(n_{H_2}=\dfrac{4,256}{22,4}=0,19\left(mol\right)\)
\(\Rightarrow x+1,5y=0,19\left(4\right)\)
Từ (3) và (4) ta có hệ: \(\left\{{}\begin{matrix}24x+27y=3,84\\x+1,5y=0,19\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,07\\y=0,08\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,07.24=1,68\left(g\right)\\m_{Al}=0,08.27=2,16\left(g\right)\end{matrix}\right.\)
2/ \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{NaOH}=\dfrac{10}{40}=0,25\left(mol\right)\\n_{H_2SO_4}=\dfrac{10}{98}=\dfrac{5}{49}\left(mol\right)\end{matrix}\right.\)
Vì \(\dfrac{n_{NaOH}}{2}=0,125>\dfrac{n_{H_2SO_4}}{1}=\dfrac{5}{49}\) nên NaOH dư còn H2SO4 hết.
Vậy quỳ tím hóa xanh.

1)
\(2Cu+O_2\rightarrow2CuO\)
a)\(n_{Cu}=\frac{2.56}{64}=0.04\left(mol\right)\)
\(\Rightarrow n_{CuO}=\frac{2}{2}\cdot n_{Cu}=\frac{2}{2}\cdot0.04=0.04\left(mol\right)\)
\(\Rightarrow m_{CuO}=0.04\cdot80=3.2\left(g\right)\)
2)
\(n_{CuO}=\frac{24}{80}=0.3\left(mol\right)\)
\(n_{Cu}=\frac{2}{2}\cdot n_{Cu}=\frac{2}{2}\cdot0.3=0.3\left(mol\right)\)
\(\Rightarrow m_{Cu}=0.3\cdot64=19.2\left(mol\right)\)
\(n_{O_2}=\frac{1}{2}\cdot n_{CuO}=\frac{1}{2}\cdot0.3=0.15\left(mol\right)\)
\(\Rightarrow m_O=0.15\cdot32=4.8\left(g\right)\)

a) nZn = 16.25/65=0.25 mol
Zn + 2HCl -> ZnCl2 + H2
(mol) 0.25 0.5 0.25 0.25
VH2 = 0.25 * 22.4 = 5.6 (l)
mH2 = 0.25 * 2 =0.5g
mHCl = 0.5 * 36.5 = 18.25g
C% = mct/mdd*100% = 18.25/225*100% = 8.11%
b) 150ml = 0.15l
nBa(OH)2 = CM * V = 2*0.15 =0.3 mol
2HCl + Ba(OH)2 -> BaCl2 + 2H2O
(mol) 2 1
(mol) 0.5 0.3
Lập tỉ lệ: 0.5/2 <0.3/1 => Ba(OH)2 dư
vậy: quì tím chuyển thành màu xanh

Bài 2:
Theo đề bài, ta có:
nZn=\(\frac{m_{Zn}}{M_{Zn}}=\frac{6,5}{65}=0,1\left(mol\right)\)
a) PTHH: Zn + 2HCl -> ZnCl2 + H2
Theo PTHH: 1:2:1:1 (mol)
Theo đề bài : 0,1:0,2:0,1:0,1 (mol)
Theo PTHH và đề bài, ta có:
\(n_{H_2}=n_{Zn}=0,1\left(mol\right)\)
=> Thể tích khí H2 thu được (ở đktc):
\(V_{H_2\left(đktc\right)}=n_{H_2}.22,4=0,1.22,4=2,24\left(l\right)\)
b) Theo PTHH và đề bài, ta có:
nHCl=2.nZn=2.0,1=0,2(mol)
=> Khối lượng HCl phản ứng:
\(m_{HCl}=n_{HCl}.M_{HCl}=0,2.36,5=7,3\left(g\right)\)
c) Theo PTHH và đề bài, ta có:
\(n_{ZnCl_2}=n_{Zn}=0,1\left(mol\right)\)
=> Khối lượng ZnCl2 tạo thành:
\(m_{ZnCl_2}=n_{ZnCl_2}.M_{ZnCl_2}=0,1.136=13,6\left(g\right)\)
1a)4Na+O2----->2Na2O
b)nNa=\(\frac{4,6}{23}=0,2\left(mol\right)\)
theo phương trình nO2=\(\frac{1}{4}\)Na=\(\frac{1}{4}\).0,2=0,05(mol)
VO2(đktc)=0,05.22,4=1,12(l)
c)MO2=0,05.32=1,6(g)
áp dụng đlbtkl,ta có:
mNa+mO2=mNa2O
<=>4,6+1,6=6,2(g)
vậy khối lượng Na2O là 6,2(g)
Bài 2:Zn+2HCl----->ZnCl2+H2
a)nZn=\(\frac{6,5}{65}=0,1\left(mol\right)\)
theo pt nH2=nZn=0,1(mol)
VH2(đktc)=0,1.22,4=2,24(l)
b)nHCl=2nZn=2.0,1=0,2(mol)
mHCl=0,2.36,5=7,3(g)
c)áp dụng đlbtkl,ta có:
mZn+mHCl=mZnCl2
<=>6,5+7,3=13,8(g)
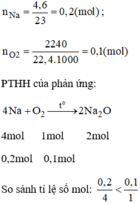
Ta có:
\(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{2240}{22400}=0,1\left(mol\right)\)
Phương trình hóa học của phản ứng:
\(4Na+O_2\rightarrow2Na_2O\)
Lập tỷ số: \(\dfrac{0,2}{4}=0,05< \dfrac{0,1}{1}\rightarrow\) Vậy \(O_2\)dư, sau phản ứng không còn Na dư nên không có khí hidro bay ra, quỳ tím chuyển thành màu xanh do\(Na_2O+H_2O\rightarrow2NaOH\)
p/s: tl góp vui :v