Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, PTHH:
2Cu + O2 -> (t°) 2CuO (1)
CuO + H2 -> (t°) Cu + H2O (2)
2Na + 2H2O -> 2NaOH + H2 (3)
2H2 + O2 -> (t°) 2H2O (4)
b, A: CuO: đồng (II) oxit
B: Cu: đồng
C: H2O: nước
D: H2: hiđro
F: O2: oxi
c, nCu = 12,8/64 = 0,2 (mol)
Theo (1): nCuO = nCu = 0,2 (mol)
Theo (2): nH2O = nCuO = 0,2 (mol)
Theo (3): nH2 = nH2O/2 = 0,2/2 = 0,1 (mol)
Theo (4): nH2O = nH2 = 0,1 (mol)
mH2O = 0,1 . 18 = 1,8 (g)

PTHH: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
\(2Cu+O_2\underrightarrow{t^o}2CuO\)
Ta có: \(n_{O_2}=\dfrac{1,6}{32}=0,05\left(mol\right)\)\(\Rightarrow n_{Cu}=n_{CuO}=0,1\left(mol\right)\)
\(\Rightarrow\%m_{CuO}=\dfrac{0,1\cdot80}{40}\cdot100\%=20\%\)
\(\Rightarrow\%m_{Fe_2O_3}=80\%\)

câu 1: nAl=0,4 mol
mHCL=54,75g=> nHCl=1,5 mol
PTHH: 2Al+6HCl=> 2AlCl3+3H2
0,4mol: 1,5mol => nHCl dư theo nAl
0,4mol-->1,2 mol-->0,4mol-->0,6mol
thể tích H2 là V=0,6.22,4=13,44ml
b) theo định luật btoan khối lượng ta có : mAlCl3=200+10,8-0,6.2=209,6g
m AlCl3=0,4.(27+35,5.3)=53,4g
=> C% AlCl3= 25,48%
PTHH: 2Al + 6HCl → 2AlCl3 + 3H2 ↑
Khối lượng chất tan HCl là:
200 . 27,375% = 54,75(gam)
Số mol của HCl là: 54,75 : 36,5 = 1,5 (mol)
Số mol của Al là: 10,8 : 27 = 0,4 (mol)
So sánh: \( {0,4{} \over 2}\) < \({1,5} \over 6\)
=> HCl dư, tính theo Al
Số mol của khí hiđrô sinh ra là: 0,4 . \(3 \ \over 2\) = 0,6 (mol)
V= 0,6 . 22,4 = 13,44 (lít)
Sau đó áp dụng định luật bảo toàn khối lượng để tính khối lượng dung dịch A:
Khối lượng nhôm + Khối lượng dung dịch axit
= Khối lượng dung dịch A + khối lượng khí hiđrô
<=> Khối lượng dung dịch A là:
10,8 + 200 - 0,6 . 2 = 209,6 (gam)
Khối lượng chất tan AlCl3 trong dung dịch A là:
0,4 . 133,5 = 53,4 (gam)
C% chất tan trong dung dịch A là:
( 53,4 : 209,6 ) . 100% = 25,48%

\(a,n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH: Zn + 2HCl ---> ZnCl2 + H2 (X là H2)
0,1-------------------------->0,1
b, \(n_{CuO}=\dfrac{9,6}{80}=0,12\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
LTL: 0,12 > 0,1 => CuO dư
hh chất sau pư: CuO, Cu
Theo pthh: nCuO (pư) = nCu = nH2 = 0,1 (mol)
=> \(\left\{{}\begin{matrix}m_{CuO\left(dư\right)}=\left(0,12-0,1\right).80=1,6\left(g\right)\\m_{Cu}=0,1.64=6,4\left(g\right)\end{matrix}\right.\)
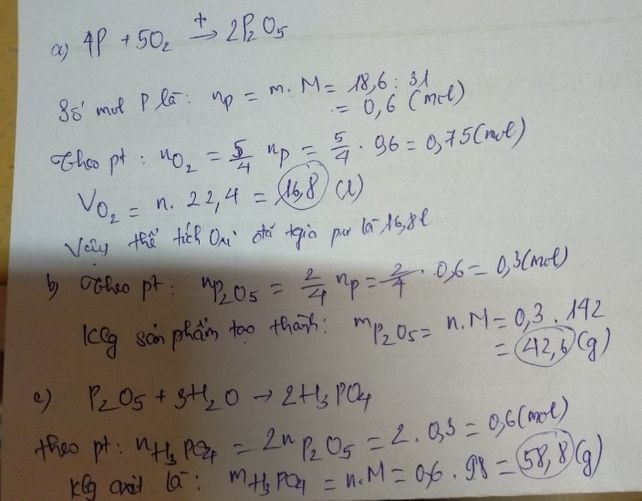
 Bạn tham khảo cách làm nhé! cho mik 1 like nha
Bạn tham khảo cách làm nhé! cho mik 1 like nha