Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Ta có phương trình: HCl + CaCO3 → CaCl2 + CO2↑ + H2O
=> Khi cho mẩu đá vôi tác dụng với dung dịch HCl thì có khí không màu thoát ra, khí đó là carbon dioxide
- Nồng độ HCl càng cao thì tốc độ phản ứng diễn ra càng nhanh.
- Giải thích: để phản ứng xảy ra, cần phải có sự va chạm giữa HCl và CaCO3. Ở ống nghiệm 2, nồng độ HCl lớn gấp đôi ở ống nghiệm 1, do vậy số va chạm của HCl và CaCO3 (trong cùng 1 đơn vị thời gian) sẽ lớn hơn, từ đó tốc độ phản ứng ở ống nghiệm 2 là lớn hơn

- Ta có phương trình: 2HCl + Fe → FeCl2 + H2↑
=> Khi cho đinh sắt tác dụng với dung dịch HCl thì có khí không màu thoát ra, khí đó là hydrogen
- Nhiệt độ càng cao, tốc độ phản ứng càng lớn

- Ta có phương trình: 2H2O2 → 2H2O + O2↑
=> Dung dịch H2O2 3% ở điều kiện thường phân hủy chậm và có khí không màu thoát ra, khí đó là Oxygen
- Khi có chất xúc tác, khí thoát ra nhiều hơn
=> Chất xúc tác MnO2 làm tăng tốc độ phân hủy H2O2

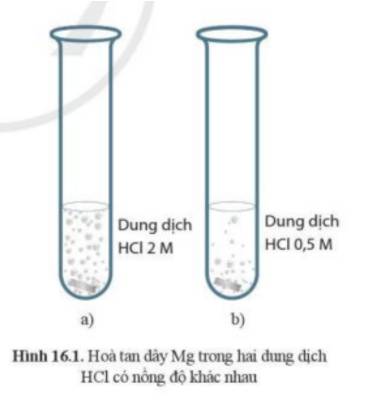
- Ở ống nghiệm (a) có hiện tượng sủi bọt khí nhiều hơn
=> Phản ứng ở ống nghiệm (a) xảy ra mãnh liệt hơn
=> Dây Mg ở ống nghiệm (a) sẽ bị tan hết trước
Mg + 2HCl → MgCl2 + H2↑

Đáp án A.
Sử dụng yếu tố diện tích tiếp xúc, diện tích tiếp xúc càng lớn, thời gian càng nhỏ.

Chọn đáp án A
Tốc độ tỉ lệ với bề mặt chất rắn → Đá vôi tan nhanh : (3) > (2) > (1)

Chọn B
Khi tăng nồng độ chất phản ứng tốc độ phản ứng tăng
→ Cốc A xuất hiện kết tủa nhanh hơn cốc B

Đáp án B
Đáp án A và C sai vì làm tăng tốc độ phản úng.
Đáp án B: nồng độ mới của axit:
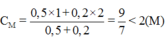
Þ giảm nồng độ axit Þ giảm tốc độ phản ứng,
Đáp án D: nồng độ mới của axit:
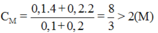
Þ tăng nồng độ axit Þ tăng tốc độ phản ứng.
- Ta có phương trình: 2HCl + CaCO3 → CaCl2 + CO2↑ + H2O
=> Khi cho mẩu đá vôi tác dụng với dung dịch HCl thì có khí không màu thoát ra, khí đó là carbon dioxide
- Diện tích bề mặt càng lớn, tốc độ phản ứng càng lớn