Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{NaOH}=0,1.3=0,3mol\\ n_{Al\left(OH\right)_3}=\dfrac{7,02}{78}=0,09mol\\ \dfrac{1}{3}n_{NaOH}>n_{Al\left(OH\right)_3}\Rightarrow NaOH\left(dư\right)\)
\(3NaOH+AlCl_3\rightarrow3NaCl+Al\left(OH\right)_3\)
0,27 0,09 0,09 0,27
\(V_{AlCl_3}=\dfrac{0,09}{2}=0,045l\)
NaOH dư thì hoà tan kết tủa tạo Na[Al(OH)4] rồi còn đâu?

Khi sục khí CO 2 vào dung dịch chứa NaOH, Na 2 CO 3 thì dung dịch thu được sau phản ứng chỉ có 2 trường hợp :
Trường hợp 1: Dung dịch thu được chứa NaHCO 3 (x mol) và Na 2 CO 3 (y mol)
+ Khối lượng hỗn hợp : 84x + 106y = 24,3 (1)
+ ĐLBTKL áp dụng với Na : x + 2y = 2.0,1 + 2.1.0,1 = 0,4 (2)
+ ĐLBTKL áp dụng với C : V/22,4 + 0,1 = x + y (3)
Giải hệ (1), (2), (3) được V = 3,36 lít.
Trường hợp 2 : Dung dịch thu được chứa NaOH (a mol) và Na 2 CO 3 (b mol)
+ Khối lượng hỗn hợp : 40a + 106b = 24,3 (4)
+ ĐLBTKL áp dụng với Na : a + 2b = 0,4 (5)
+ ĐLBTKL áp dụng với C: V/22,4 + 0,1 = b
Giải hệ (4), (5) và (6) thấy không có nghiệm.

nCa(OH)2= 0,2.1 = 0,2 mol.
nCaCO3 = 15 : 100 = 0,15mol
Cho NaOH vào dung dịch sau PƯ thấy xuất hiện kết tủa nên trong dd có muối Ca(HCO3)2
Vậy xảy ra 2 phản ứng:
CO2 + Ca(OH)2 -----> CaCO3 + H2O (1)
0,15 mol 0,15 mol 0,15 mol
2CO2 + Ca(OH)2 ------> Ca(HCO3)2 (2)
2. 0,05 mol 0,05 mol
Theo (1) : nCO2(1) = nCa(OH)2 (1) = nCaCO3 = 0,15mol
=> nCa(OH)2 (2) = 0,2 - 0,15 = 0,05 mol
Theo (2) : nCO2 (2) = 2. 0,05 = 0,1 mol
=> nCO2 = 0,15 + 0,1 = 0,25 mol
=> VCO2 = 0,25 . 22,4 = 5,6 (L)
nCaCO3 = 10 / 100 = 0,1 chứ ạ !!
vì m kết tủa bằng 10 chứ ạ ???? giải thích hộ vs ạ

\(n_{NaOH}=0,2\left(mol\right)\)
- TH1:
\(n_{BaSO3}=\frac{5,425}{217}=0,025\left(mol\right)=n_{Na2SO3}\)
\(Na_2SO_3+BaCl_2\rightarrow BaSO_3+2NaCl\)
- TN2:
\(Na_2SO_3+Ca\left(OH\right)_2\rightarrow CaSO_3+2NaOH\)
\(\Rightarrow n_{CaSO3}=n_{Na2SO3}=0,025\left(mol\right)\)
\(\Rightarrow m_{CaSO3}=3g< 12g\)
=> X có muối axit
\(2NaHSO_3+Ca\left(OH\right)_2\rightarrow CaSO_3+Na_2SO_3+2H_2O\)
\(n_{CaSO3}=\frac{12-3}{120}=0,075\left(mol\right)\)
\(\Rightarrow n_{NaHSO3}=0,15\left(mol\right)\)
Trong 200ml X có 0,15.2= 0,3 mol NaHSO3 và 0,025.2= 0,05 mol Na2SO3
\(\Rightarrow n_{SO2}=n_{NaHSO3}+n_{Na2SO3}=0,35\left(mol\right)\)
\(\Rightarrow V=7,84\left(l\right)\)
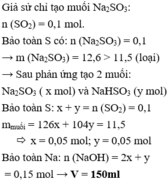
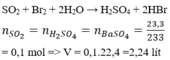
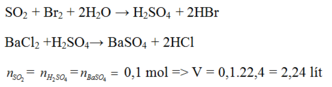
\(n_{NaOH}=0,2\cdot1,2=0,24mol\\ n_{Al\left(OH\right)_3}=\dfrac{6,24}{78}=0,08mol=\dfrac{n_{NaOH}}{3}\Rightarrow V_{min}:vd.AlCl_3\\ V=\dfrac{0,08}{1}=0,08\left(L\right)=80\left(mL\right)\)