Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{NaOH}=0,2\cdot1,2=0,24mol\\ n_{Al\left(OH\right)_3}=\dfrac{6,24}{78}=0,08mol=\dfrac{n_{NaOH}}{3}\Rightarrow V_{min}:vd.AlCl_3\\ V=\dfrac{0,08}{1}=0,08\left(L\right)=80\left(mL\right)\)

Theo giả thiết ta có: \(n_{Al_2\left(SO_4\right)_3}=0,08\left(mol\right)\)
\(Al_2\left(SO_4\right)_3+3Ba\left(OH\right)_2\rightarrow2Al\left(OH\right)_3+3BaSO_4\) (1)
\(2Al\left(OH\right)_3+Ba\left(OH\right)_2\rightarrow Ba\left(AlO_2\right)_2+4H_2O\) (2)
Giả sử kết tủa chỉ là BaSO4 thì nhận thấy \(n_{\downarrow}< n_{SO_4}\). Do đó chỉ xảy ra phản ứng (1).
Gọi số mol Ba(OH)2 là x (mol)
Bảo toàn nguyên tố ta có: \(n_{BaSO_4}=x\left(mol\right);n_{Al\left(OH\right)_3}=\dfrac{2x}{3}\left(mol\right)\)
\(\Rightarrow233x+78.\dfrac{2x}{3}=51,3\Rightarrow x=0,18\)
\(\Rightarrow V=\dfrac{0,18}{2}=0,09\left(l\right)\)

\(n_{AgNO_3}=0,009.2=0,018\left(mol\right)\\ n_{NaX}=1,5.0,01=0,015\left(mol\right)\\ NaX+AgNO_3\rightarrow AgX\downarrow+NaNO_3\\ Vì:\dfrac{0,018}{1}>\dfrac{0,015}{1}\\ \Rightarrow AgNO_3dư\\ \Rightarrow n_{AgX}=n_{NaX}=0,015\left(mol\right)\\ \Rightarrow M_{AgX}=\dfrac{2,82}{0,015}=188\left(\dfrac{g}{mol}\right)=M_{Ag}+M_X=M_X+108\\ \Leftrightarrow M_X=80\left(\dfrac{g}{mol}\right)\\ \Rightarrow X:Brom\left(Br=80\right)\\ 2,dd.sau.phản.ứng:AgNO_3\left(dư\right),NaNO_3\\ n_{AgNO_3\left(p.ứ\right)}=n_{NaNO_3}=n_{NaBr}=0,015\left(mol\right)\\ \Rightarrow n_{AgNO_3\left(dư\right)}=0,018-0,015=0,003\left(mol\right)\)

Khi sục khí CO 2 vào dung dịch chứa NaOH, Na 2 CO 3 thì dung dịch thu được sau phản ứng chỉ có 2 trường hợp :
Trường hợp 1: Dung dịch thu được chứa NaHCO 3 (x mol) và Na 2 CO 3 (y mol)
+ Khối lượng hỗn hợp : 84x + 106y = 24,3 (1)
+ ĐLBTKL áp dụng với Na : x + 2y = 2.0,1 + 2.1.0,1 = 0,4 (2)
+ ĐLBTKL áp dụng với C : V/22,4 + 0,1 = x + y (3)
Giải hệ (1), (2), (3) được V = 3,36 lít.
Trường hợp 2 : Dung dịch thu được chứa NaOH (a mol) và Na 2 CO 3 (b mol)
+ Khối lượng hỗn hợp : 40a + 106b = 24,3 (4)
+ ĐLBTKL áp dụng với Na : a + 2b = 0,4 (5)
+ ĐLBTKL áp dụng với C: V/22,4 + 0,1 = b
Giải hệ (4), (5) và (6) thấy không có nghiệm.

\(n_{NaBr}=1,2.0,1=0,12\left(mol\right)\)
\(m_{AgNO3}=\frac{8,5.200}{100}=17\left(g\right)\)
\(n_{AgNO3}=\frac{17}{170}=0,1\left(mol\right)\)
\(PTHH:NaBr+AgNO_3\rightarrow NaNO_3+AgBr\downarrow\)
Lập tỉ lệ: \(\frac{0,12}{1}>\frac{0,1}{1}\Rightarrow\)NaBr dư, AgNO3 hết
\(n_{AgBr}=n_{AgNO3}=0,1\left(mol\right)\)
\(\Rightarrow m_{AgBr}=0,1.188=18,8\left(g\right)\)

nNaCl=0,2.2=0,4(mol)
nAgNO3=0,15.2=0,3(mol)
PTHH: NaCl + AgNO3 -> AgCl (kt trắng)+ NaNO3
Ta có: 0,4/1 > 0,3/1
=> AgNO3 hết, NaCl dư, tính theo nAgNO3
=> nAgCl= nAgNO3=0,3(mol)
=> m(kết tủa)=mAgCl=0,3.143,5=43,05(g)
=> Chọn A
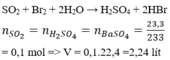
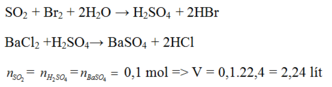
\(n_{NaOH}=0,1.3=0,3mol\\ n_{Al\left(OH\right)_3}=\dfrac{7,02}{78}=0,09mol\\ \dfrac{1}{3}n_{NaOH}>n_{Al\left(OH\right)_3}\Rightarrow NaOH\left(dư\right)\)
\(3NaOH+AlCl_3\rightarrow3NaCl+Al\left(OH\right)_3\)
0,27 0,09 0,09 0,27
\(V_{AlCl_3}=\dfrac{0,09}{2}=0,045l\)
NaOH dư thì hoà tan kết tủa tạo Na[Al(OH)4] rồi còn đâu?