Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nH2=\(\dfrac{1,68}{22,4}\)=0,075mol
Fe + H2SO4 -> FESO4 + H2
n ban đầu: 0,2mol
n pứ: 0,075mol 0,075mol 0,075mol
Vì \(\dfrac{0,2}{1}\)>\(\dfrac{0,075}{1}\) nên H2SO4 dư
a) mFe pứ= 0,075.56=4,2g
b) Fe2O3 + 3H2 -> 2Fe + 3H2O
n pứ: 0,0375mol 0,075mol
mFe2O3 pứ=0,0375.160=6g

3 Fe + 2 O2 ----> Fe3O4
0,9 0,6 0,3
nFe= 50,4/56=0,9 mol
VO2 = 0,6 x 22,4= 13,44 lít
mFe3O4 = 0,3 x232=69,6 g

a, Ta có pt pư
\(Fe+H_2SO_4-->FeSO_4+H_2\)
Ta có
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\)
=> \(H_2SO_4\) dư
\(m_{H_2SO_4}=0,15\cdot98=14,7\left(g\right)\)
\(\Rightarrow m_{dư\left(H_2SO_4\right)}=19,6-14,7=4,9\left(g\right)\)
b,
Ta có
\(m_{Fe}=0,15\cdot56=8,4\left(g\right)\)

nFe=0,1mol
PTHH: Fe+H2SO4=> FeSO4+H2
0,1mol:0,2mol
ta thấy nH2SO4 dư theo nFe
P/Ư: 0,1mol->0,1mol->0,1mol->0,1mol
=> thể tích H2 thu được sau phản ứng v=0,1.22,4=2,24ml

\(n_{CuSO_4}=\dfrac{25.1,12.15}{160.100}=0,02625mol\)
Fe+CuSO4\(\rightarrow\)FeSO4+Cu
x\(\rightarrow\)x.................x.........x
-Độ tăng khối lượng=64x-56x=2,58-2,5
\(\rightarrow\)8x=0,08\(\rightarrow\)x=0,01
mCu=n.M=0,01.64=0,64gam
\(n_{CuSO_4\left(dư\right)}=0,02625-0,01=0,01625mol\)
\(m_{CuSO_4\left(dư\right)}=0,01625.160=2,6gam\)
\(n_{FeSO_4}=0,01mol\rightarrow m_{FeSO_4}=0,01.152=1,52gam\)
\(m_{dd}=25.1,12-0,08=27,92gam\)
C%FeSO4=\(\dfrac{1,52.100}{27,92}\approx5,44\%\)
C%CuSO4=\(\dfrac{2,6.100}{27,92}\approx9,3\%\)

PTPỨ: Zn + ZnSO4 (dư) -----> CuSO4 + H2
3,01875mol X (số cần tìm) mol
a) nCuSO4 =m:M = 483: 160 = 3,01875 (lật ngược lên trên phương trình đặt và tìm X)
Vậy X = 3,01875.1/1 = 3,01875
=> Vh2= n .22,4 = 3,01875 .22,4 = 67,62 L
b) ta có nzn = n CuSO4= 3,01875 => mZn = n.M = 3,01875 . 65 = 196,21875 g
(bạn không nên ghi nét đứt như mình nhé, sai đó, do bàn phím mình không có nét thẳng)

a) PTHH: \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
b+c) Ta có: \(n_P=\dfrac{22,4}{31}=\dfrac{112}{155}\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{P_2O_5}=\dfrac{56}{155}\left(mol\right)\\n_{O_2}=\dfrac{28}{31}\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{P_2O_5}=\dfrac{56}{155}\cdot142\approx51,3\left(g\right)\\V_{O_2}=\dfrac{28}{31}\cdot22,4\approx20,23\left(l\right)\end{matrix}\right.\)
c) Ta có: \(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{\dfrac{112}{155}}{4}>\dfrac{0,3}{5}\) \(\Rightarrow\) Photpho còn dư, Oxi p/ứ hết

a)\(Fe+H2SO4-->FeSO4+H2\)
\(n_{Fe}=\frac{28}{56}=0,5\left(mol\right)\)
\(n_{H2SO4}=n_{Fe}=0,5\left(mol\right)\)
\(m_{H2SO4}=0,5.98=49\left(g\right)\)
b)\(n_{H2}=n_{Fe}=0,5\left(mol\right)\)
\(V_{H2}=0,5.22,4=11,2\left(l\right)\)
c)\(n_{FeSO4}=n_{Fe}=0,5\left(mol\right)\)
\(m_{FeSO4}=0,5.152=76\left(g\right)\)
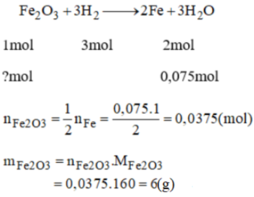
nH2=3,36/22,4=0,15(mol)
Fe+H2SO4--->FeSO4+H2
0,15___0,15__________0,15
mFe=0,15.56=8,4(g)
b)H2SO4 dư sau p/ứ
mH2SO4 dư=(0,4-0,15).98=24,5(g)
phôi bào Fe hở???