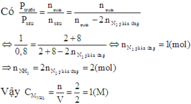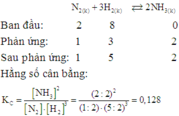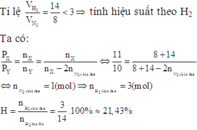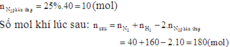Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)Tại tđ cân bằng:
\(\left[N_2\right]=0,5-\dfrac{1}{2}.0,1=0,5-0,05=0,45\left(M\right)\)
\(\left[H_2\right]=0,6-\dfrac{3}{2}.0,1=0,6-0,15=0,45\left(M\right)\)
\(\Rightarrow k_c=\dfrac{\left[NH_3\right]^2}{\left[N_2\right].\left[H_2\right]^3}=\dfrac{0,1^2}{0,45.0,45^3}\approx0,244\)
b) Để tăng H tổng hợp \(NH_3\), chúng ta có thể:
- Tăng P bằng cách giảm V (chọn P phù hợp)
- Giảm nhiệt độ của hệ ( chọn nhiệt độ phù hợp)
- Thêm \(N_2;H_2\)

Đáp án D.
N2+ 3H2 ⇌ 2NH3
Dựa vào công thức: PV=nRT
Ở nhiệt độ và thể tích không đổi (thể tích bình chứa luôn là 4 lít) và R là hằng số thì áp suất (P) tỉ lệ với số mol (n)
Theo đề áp suất sau bằng 9/10 áp suất ban đầu
→nkhí sau pứ= 9/10.nkhí ban đầu= 9/10. (8+16)= 21,6 mol
nNH3= nkhí trước pứ- nkhí sau pứ= (8+16)- 21,6= 2,4 mol


............ ....... C... + ..CO2 <=> 2CO
Ban đầu:.. 0,2 mol......1
p.ư:............a mol.........a..............2a
Lúc cân =:0,2-a.........1-a.............2a
Kc=[CO]^2/[CO2] =(2a/22,4)^2 / [(1-a)/22,4) =0,002
Giải ra ta có a=0,1
=>Ở trạng thái cân bằng:
nCO=2.0,1=0,2 mol
nCO2=1-0,1=0,9 mol
nC=0,2-0,1=0,1 mol