Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.
Do E gồm hai oxit nên Mg, CuCl2 hết, Fe đã phản ứng
Phương trình
Mg + CuCl2 \(\rightarrow\) MgCl2 + Cu (1)
Fe + CuCl2 \(\rightarrow\) FeCl2 + Cu (2)
Khi cho NaOH dư vào
2NaOH + MgCl2 \(\rightarrow\) Mg(OH)2 + 2NaCl (3)
2NaOH + FeCl2 \(\rightarrow\) Fe(OH)2 + 2NaCl (4)
Khi nung
Mg(OH)2 \(\underrightarrow{t^o}\) MgO + H2O (5)
4Fe(OH)2 +O2 \(\underrightarrow{t^o}\) 4Fe2O3 + 4H2O (6)
b.
Đặt số mol của Fe, Mg có ban đầu lần lượt là x, y, số mol Fe dư là t (x, y>0, t\(\ge\)0)
Có hệ \(\begin{cases}24x+56y+0t=3,16\\40x+64y-8t=3,84\\40x+80y-80t=1,4\end{cases}\)\(\Rightarrow\)\(\begin{cases}x=0,015mol\\y=0,05mol\\t=0,04mol\end{cases}\)
Vậy trong hỗn hợp đầu %mMg = \(\frac{0,015.24}{3,16}.100\)=11,392%
%mFe=100%-11,392% = 88,608%
Nồng độ của CuCl2: z =0,025:0,25=0,1M

a, Ta có: $n_{O}=0,6(mol)$
Suy ra $n_{H^+/pu}=1,2(mol)\Rightarrow n_{H_2SO_4}=0,6(mol)$
Bảo toàn khối lượng ta có: $m_{muoi}=29,6+0,6.96=87,2(g)$

Chất rắn gồm : Ag,Cu dư
\(n_{Ag} = n_{AgNO_3} = 0,1(mol)\\ \Rightarrow n_{Cu} = \dfrac{15,92-0,1.108}{64} = 0,08(mol)\)
Gọi \(n_{Cu} = n_{Fe} = a(mol)\)
Dung dịch sau phản ứng :
\(Fe^{2+} : a + 0,14\\ Cu^{2+} : a - 0,08\\ NO_3^- : 0,1 + 0,14.3 = 0,52(mol)\)
Bảo toàn điện tích : 2(a+0,14) + 2(a -0,08) = 0,52
⇒ a = 0,1
Vậy \(n_{Fe^{2+}} = a + 0,14 = 0,24(mol)\)
Bảo toàn e :
\(n_{Fe^{2+}} = 3n_{NO}\\ \Rightarrow n_{NO} = \dfrac{0,24}{3} = 0,08(mol)\\ \Rightarrow V = 0,08.22,4 = 1,792(lít)\)
Đáp án C
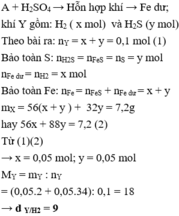
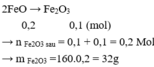



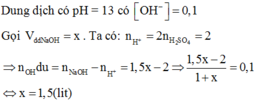
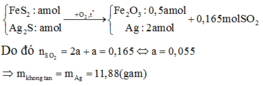
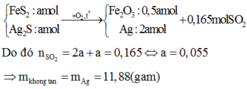
n(acid) = \(\frac{200\cdot0,8}{1000}\) = 0,16 (mol)
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
(mol) 0,05 0,16
pư : 0,04 ← 0,16
dư : 0,01 0
Rắn sau pư (A) có Fe3O4 ( 0,01 mol) và Cu ( 0,07 mol)
m (A) = mFe3O4 (dư) + mCu = 0,01 * 232 + 0,07 * 64 = 6,8 (g)