Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

số mol kẽm tham gia phản ứng là:\(n_{Zn}=\frac{m}{M}=\frac{6,5}{65}=0,1\left(mol\right)\)
PTHH:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 (mol)
a, thể tích khí hiđro thu được là:\(V_{H_2}=n_{H_2}\times22,4=0,1\times22,4=2,24\left(l\right)\)
b,khối lượng HCl cần dùng là:\(m_{HCl}=n_{HCl}\times M=0,2\times65=13\left(g\right)\)

1.
mNaCl lí thuyết = \(\dfrac{4,68.100}{80}\) = 5,85 (g)
=> nNaCl lí thuyết = \(\dfrac{5,85}{58,5}\) = 0,1 (mol)
2Na + Cl2 ----> 2NaCl
0,1 0,05 0,1 (mol)
=> mNa = 0,1.23 = 2,3 (g)
=> VCl2 = 0,05.22,4 = 1,12 (l)
2.
nZn = \(\dfrac{19,5}{65}\)= 0,3 (mol)
nCl2 = \(\dfrac{7}{22,4}\)= 0,3125 (mol)
Zn + Cl2 ----> ZnCl2
0,3 0,3 (mol)
Tỉ lệ: \(\dfrac{0,3}{1}<\dfrac{0,3125}{1}\)=> Zn phản ứng hết, Cl2 phản ứng dư.
=> mZnCl2 lí thuyết 0,3.136 = 40,8 (g)
=> H = \(\dfrac{36,72.100}{40,8}\)= 90%

Đáp án C
Gọi công thức muối cần tìm là MX2.
Khi cho 150 gam dung dịch X tác dụng với dung dịch Na2CO3 dư có phản ứng:
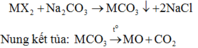
Do đó khí hấp thụ vào dung dịch KOH là CO2.
Vì sau phản ứng trong dung dịch vẫn còn KOH nên sản phẩm tạo thành là K2CO3:
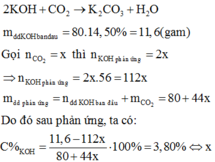 = 0,75
= 0,75

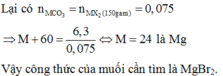

\(2NaBr+Cl_2\rightarrow2NaCl+Br_2\left(1\right)\\ m_{giảm}=m_{Br_2}-m_{Cl_2}\\ \Leftrightarrow n_{NaCl\left(1\right)}=n_{NaBr\left(1\right)}=\dfrac{13,35}{160-71}=0,15\left(mol\right)\\ \Rightarrow\%m_{NaBr}=\dfrac{103.0,15}{42,6}.100\approx36,268\%\\ \Rightarrow\%m_{NaCl}\approx63,732\%\)
Bổ sung:
\(C\%_{ddNaBr\left(trongA\right)}=\dfrac{0,15.103}{200}.100=7,725\%\\ C\%_{ddNaCl\left(trongA\right)}=\dfrac{42,6-0,15.103}{200}.100=13,575\%\)


\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
PTHH: 2Fe + 3Cl2 --to--> 2FeCl3
0,4-->0,6
MnO2 + 4HCl --> MnCl2 + Cl2 + 2H2O
2,4<-------------0,6
=> \(n_{NaCl}=2,4\left(mol\right)\)
=> \(\%NaCl=\dfrac{2,4.58,5}{200}.100\%=70,2\%\)