Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) PTHH: Fe + 2HCl ===> FeCl2 + H2
H2 + CuO =(nhiệt)=> Cu + H2O
Ta có: nFe = \(\frac{11,2}{56}=0,2\left(mol\right)\)
=> nH2 = nCuO = nFe = 0,2 (mol)
=> mCuO = 0,2 x 80 = 16 (gam) = m
b) Theo phương trình, nFeCl2 = nFe = 0,2 (mol)
=> mFeCl2 = 0,2 x 127 = 25,4 (gam)
nFe=m:M=11,2:56=0,2mol
PT:Fe+HCl--->FeCl2+H2
theo PT:1mol:1mol:1mol:1mol
theo đề:0,2mol:0,2mol:0,2mol:0,2mol
CuO+H2--->Cu+H2O
theo PT:1mol:1mol:1mol:1mol
theo đề:0,2mol:0,2mol:0,2mol:0,2mol
a.mCuO=n.M=0,2.80=16g
b.mFeCl2=n.M=0,2.127=25,4g

a) Theo đề bài, ta có:
nFe= \(\frac{m_{Fe}}{M_{Fe}}=\frac{28}{56}=0,5\left(mol\right)\)
PTHH: Fe + 2HCl -> FeCl2 + H2
Theo PTHH : 1:2:1:1 (mol)
Theo đề bài: 0,5:1:0,5:0,5 (mol)
b) Theo PTHH và đề bài, ta có:
\(n_{FeCl_2}=n_{Fe}\)= 0,5 (mol)
Khối lượng sắt clorua tạo thành:
\(m_{FeCl_2}=n_{FeCl_2}.M_{FeCl_2}=0,5.127=63,5\left(g\right)\)
c) nFe= \(\frac{m_{Fe}}{M_{Fe}}=\frac{14}{56}=0,25\left(mol\right)\)
Theo PTHH và đề bài, ta được:
nHCl= 2.nFe= 2.0,25=0,5 (mol)
Khối lượng HCl đã phản ứng:
mHCl=nHCl . MHCl= 0,5 . 36,5 = 18,25 (g)
a)
PTHH : Fe + 2HCl ---) FeCl2 + H2
b)
Số mol của Sắt là :
\(n_{Fe}=\frac{m_{Fe}}{M_{Fe}}=\frac{28}{56}=0,5\left(mol\right)\)
PTHH : Fe + 2HCl ---) FeCl2 + H2
Theo PTHH : 1 : 2 : 1 : 1 (mol)
Théo bài ra : 0,5--)1---------)0,5--------)0,5 (mol)
Khối lượng FeCl2 tạo thành là :
\(m_{FeCl_2}=n_{FeCl_2}\times M_{FeCl_2}=0,5\times\left(56+2\times\left(35,5\right)\right)=63,5\left(g\right)\)
Nếu phân nửa lượng sắt trên thành 14 g sắt thì số mol của sắt là :
\(n_{Fe}=\frac{m_{Fe}}{M_{Fe}}=\frac{14}{56}=0,25\left(mol\right)\)
mà Số mol của HCl gấp 2 lần số mol của sắt
Suy ra Nếu lấy phân nửa lượng sắt thì cần 0,5 mol HCl để phản ứng
Vậy khối lượng của HCl là :
\(m_{HCl}=n_{HCl}\times M_{HCl}=0,5\times\left(1+35,5\right)=18,25\left(g\right)\)
Chúc bạn học tốt =))![]()

Fe + 2HCl --> FeCl2 + H2
nFe = \(\dfrac{11,2}{56}\)=0,2 mol . Theo tỉ lệ phản ứng => nFeCl2 = nH2 = 0,2 mol
a. H2 + CuO --> Cu + H2O
nCuO = nH2 => mCuO = 0,2 . 80 = 16 gam
b. mFeCl2 = 0,2 .127= 25,4 gam

PTPU :
Fe + 2HCl --> FeCl2 + H2
H2 + CuO --> Cu + H2O
TBR, ta có nFe = 11,2 /56 = 0,2 (mol)
Theo PTHH, nFeCl2 = nH2 = 0,2 mol
Theo PTHH nCuO = nH2 => mCuO = 0,2 . 80 = 16 gam
TBR, ta có: mFeCl2 = 0,2 .127= 25,4 gam
Vậy

Ta có: \(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
\(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
\(PTHH:\)
\(Fe+2HCl--->FeCl_2+H_2\left(1\right)\)
\(CuO+H_2\overset{t^o}{--->}Cu+H_2O\left(2\right)\)
a. Theo PT(1): \(n_{H_2}=n_{Fe}=0,15\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,15.22,4=3,36\left(lít\right)\)
b. Ta thấy: \(\dfrac{0,15}{1}< \dfrac{0,2}{1}\)
Vậy CuO dư.
Theo PT(2): \(n_{Cu}=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,15.64=9,6\left(g\right)\)

Fe2O3 + 6HCl -> 2FeCl3 + 3H2O
0.3 1.8 0.6
\(nFe2O3=\dfrac{48}{160}=0.3mol\)
a.\(mFeCl3=0.6\times162.5=97.5g\)
b.\(mHCl=1.8\times36.5=65.7g\)
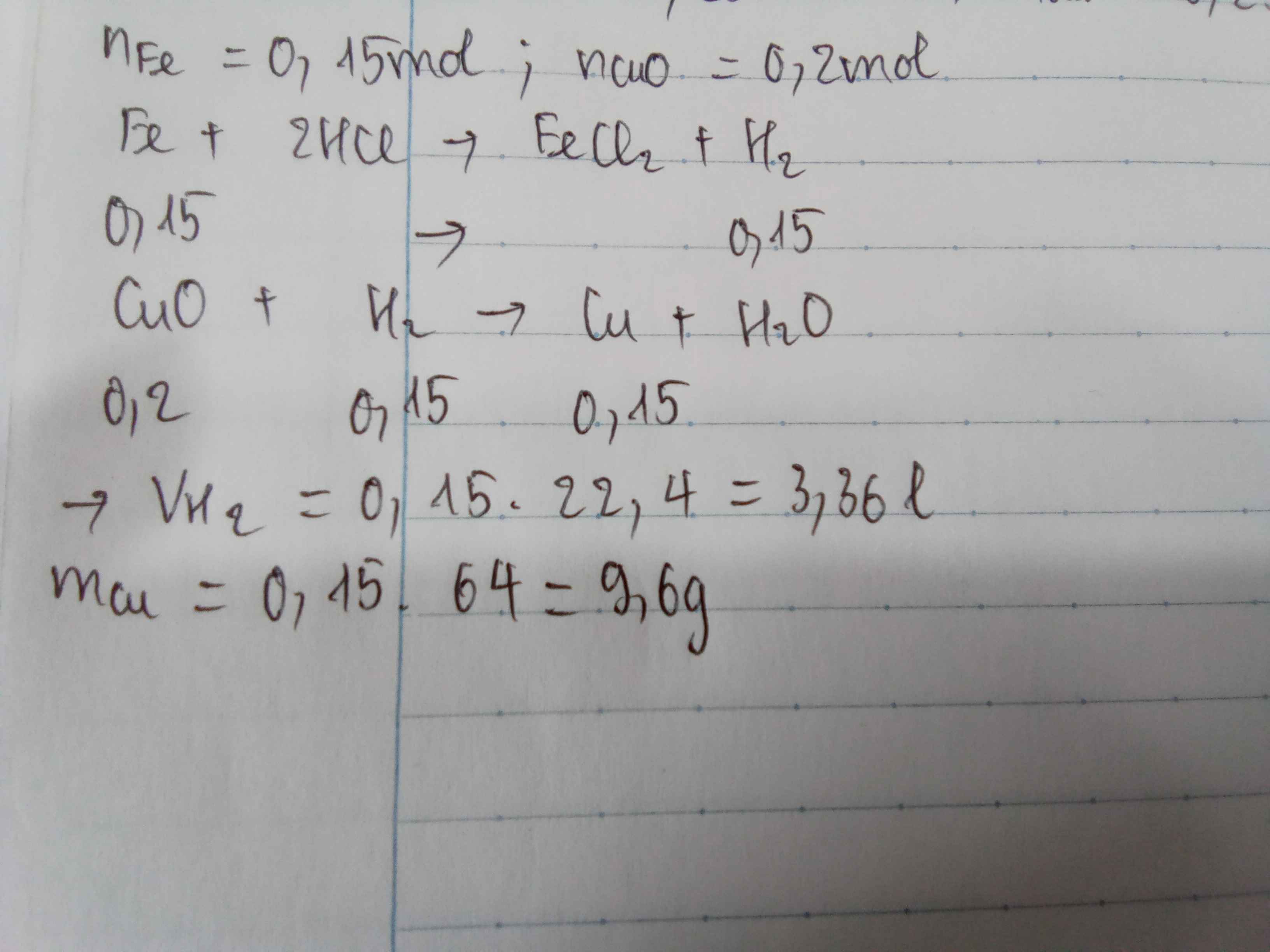

\(\text{ H2 + CuO}\rightarrow\text{ Cu + H2O}\)
\(n_{CuO}=\frac{32}{160}=0,2\left(mol\right)\)
\(\rightarrow\)n H2 = 0,2 mol
\(\text{Fe +2 HCl }\rightarrow\text{ FeCl2 + H2}\)
n Fe = n FeCl2 = n H2 = 0,2 mol
\(\rightarrow\text{a = 56.0,2 = 11,2g}\)
\(\Rightarrow\text{m FeCl2 = 0,2.127 = 25,4g}\)