Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.Ta có: nHCl=1.\(\frac{200}{1000}\)=0,2(mol)
Ta có phương trình 2Al + 6HCl -----> 2AlCl3 + 3H2 (1)
Theo phương trình: 2 mol 6 mol 3 mol
Theo đề: x mol 0,2 mol 0,1 mol
=> V\(H_2\)=0,1.22,4=2,24(l)
b. Từ pt (1), ta có:
mAl=x.27=\(\frac{0,2.2}{6}\).27=1,8(g)
c.Từ pt (1), ta có: mHCl=0,2. (1+35,5)=7,3(g)
mdd=\(\frac{200}{1000}.22,4.18=80,64\left(g\right)\)
=>C%=\(\frac{7,3}{80,64}.100\%=9,1\%\)
Ungr hộ nha!

\(1.m_{CaCO_3}=400.85\%=340\left(g\right)\\ \rightarrow n_{CaCO_3}=\frac{340}{100}=3,4\left(mol\right)\\ PTHH:CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\uparrow\\ V_{CO_2}=3,4.22,4=76,16\left(l\right)\\ m_{HCl}=3,4.2.36,5=248,2\left(g\right)\\ m_{CaCl_2}=3,4.111=377,4\left(g\right)\)
\(2.\\ PTHH:C+O_2\underrightarrow{t^o}CO_2\\ PTHH:S+O_2\underrightarrow{t^o}SO_2\\ n_{SO_2}=\frac{4,48}{22,4}=0,2\left(mol\right)\\ \rightarrow m_S=0,2.32=6,4\left(g\right)\\ m_C=\sum_m-m_S=10-6,4=3,6\left(g\right)\\ \%_C=\frac{3,6}{10}.100=36\left(\%\right)\\ n_C=\frac{3,6}{12}=0,3\left(mol\right)\\ \sum n_{O_2}=0,3+0,2=0,5\left(mol\right)\\ \rightarrow V_{O_2}=0,5.22,4=11,2\left(l\right)\\ \rightarrow V_{KK}=5.11,2=56\left(l\right)\\ V_{CO_2}=0,3.22,4=6,72\left(l\right)\)

bài 1 :
a)giả sử hỗn hợp chỉ chứa kim loại Mg
=> nHCl =2nMg = 2.0,35 = 0,7mol
giả sử hỗn hợp chỉ chứa kim loại Zn
=> nHCl =2nZn \(\simeq\) 2.0,13 = 0,26mol
=> 0,26mol < nHClpư < 0,7mol
mà nHCl(ban đầu) = 1mol( 1mol>0,7mol)
=> Axit dư
b) Gọi x và y lần lượt là số mol của Zn và Mg trong hỗn hợp :
⇒ 65x + 24y = 8,4 (1)
Do HCl dư nên ta ko quan tâm tới số mol HCl ta có :
Zn(x)=>H2(x)Zn(x)=>H2(x)
Mg(y)=>H2(y)Mg(y)=>H2(y)
nH2=4,4822,4=0,2(mol)nH2=4,4822,4=0,2(mol)
=>x+y=0,2(2)=>x+y=0,2(2)
Giải hệ ( 1),(2) có :
x=18205=nZn;y=23205=nMg
=>mZn=18205.65=5,7(g)
nMg=23205.24=2,7(g)
bài 2 :
PTHH : Mg + H2SO4 -> MgSO4 + H2 (1)
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2 (2)
500ml =0,5(l)=>nH2SO4 = 0,5 (mol)
Gọi số mol của Mg , Al lần lượt là x,y (mol) với x,y>0
Theo(1) , nH2SO4 = x (mol)
Theo (2),nH2SO4 = 32y(mol)32y(mol)
Giả sử H2SO4 phản ứng hết => x+32y=0,532y=0,5=> x+y >0,5 (*)
Theo bài ra : 24x + 27y =7,8
<=>24x+24y = 7,8 - 3y
=> 24(x+y) < 7,8
=> x+y < 7,824=0,3257,824=0,325 , mâu thuẫn với (*) => H2SO4 dư <=> axit dư
b, nH2= 8,96/22,4 =0,4 (mol) . Theo (1) và (2) =>x+32y=0,432y=0,4
Vì axit dư nên kim loại hết
suy ra ta có hệ
⎧⎩⎨x+32y=0,424x+27y=7,8⇔{x=0,1y=0,2{x+32y=0,424x+27y=7,8⇔{x=0,1y=0,2
=> mMg = 2,4 (g)
=> mAl = 5,4 (g)
% mMg = 2,47,8.100%≈30,77%2,47,8.100%≈30,77%
%mAl = 69,23%

C1: Độ tan của KNO3 ở 20oC là:
S KNO3= 60/190*100= 31.57g
C2:
nFe= 25.2/56=0.45 mol
3Fe + 2O2 -to-> Fe3O4
0.45___0.3
VO2= 0.3*22.4=6.72l
2KClO3 -to-> 2KCl + 3O2
0.2________________0.3
mKClO3= 0.2*122.5=24.5g
Câu 1:
\(S^{20^0C}_{KNO_3}=\frac{60}{190}.100=31,57\left(g\right)\)
Câu 2:
a) \(3Fe+2O_2\underrightarrow{t^0}Fe_3O_4\left(1\right)\)
b) \(n_{Fe}=\frac{25,2}{56}=0,45\left(mol\right)\)
Theo PTHH (1): \(n_{Fe}:n_{O_2}=3:2\)
\(\Rightarrow n_{O_2}=n_{Fe}.\frac{2}{3}=0,45.\frac{2}{3}=0,3\left(mol\right)\)
\(\Rightarrow V_{O_2\left(đktc\right)}=0,3.22,4=6,72\left(l\right)\)
c) PTHH: \(2KClO_3\underrightarrow{t^0}2KCl+3O_2\left(2\right)\)
Theo PTHH (2): \(n_{O_2}:n_{KClO_3}=3:2\)
\(\Rightarrow n_{KClO_3}=n_{O_2}.\frac{2}{3}=0,3.\frac{2}{3}=0,2\left(mol\right)\)
\(\Rightarrow m_{KClO_3}=0,2.122,5=24,5\left(g\right)\)

Ta có: \(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
a, PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
_____0,05__0,1____________0,05 (mol)
b, mFe = 0,05.56 = 2,8 (g)
c, mHCl = 0,1.36,5 = 3,65 (g)
\(\Rightarrow m_{ddHCl}=\dfrac{3,65}{10\%}=36,5\left(g\right)\)
Bạn tham khảo nhé!

Fe + 2HCl \(\rightarrow\)FeCl2 + H2
nFe=\(\dfrac{8,4}{56}=0,15\left(mol\right)\)
Theo PTHH ta có:
nFe=nH2=0,15(mol)
VH2=0,15.22,4=3,36(lít)
b;Theo PTHH ta có:
2nFe=nHCl=0,3(mol)
mHCl=0,3.36,5=10,95(g)
mdd HCl=\(10,95:\dfrac{10,95}{100}=100\left(g\right)\)
c;
Theo PTHH ta có:
nFe=nFeCl2=0,15(mol)
mFeCl2=0,15.127=19,05(g)
C% dd FeCl2=\(\dfrac{19,05}{8,4+100-0,15.2}.100\%=17,6\%\)
nFe=m/M=8,4/56=0,15(mol)
PT: Fe + 2HCl -> FeCl2 +H2
vậy:0,15-->0,3----->0,15-->0,15(mol)
=> VH2=n.22,4=0,15.22,4=3,36(lít)
b)mHCl=n.M=0,3.36,5=10,95(g)
\(\Rightarrow m_{ddHCl}=\dfrac{m_{HCl}.100\%}{C\%}=\dfrac{10,95.100}{10,95}=100\left(g\right)\)
c) md d sau phan ứng=mFe +md d HCl-mH2=8,4+100-(0,15.2)=108,1(g)
mFeCl2=n.M=0,15.127=19,05(g)
\(\Rightarrow C\%_{ddsauphanung}=\dfrac{m_{FeCl_2}.100\%}{m_{ddsauphanung}}=\dfrac{19,05.100}{108,1}\approx17,622\left(\%\right)\)
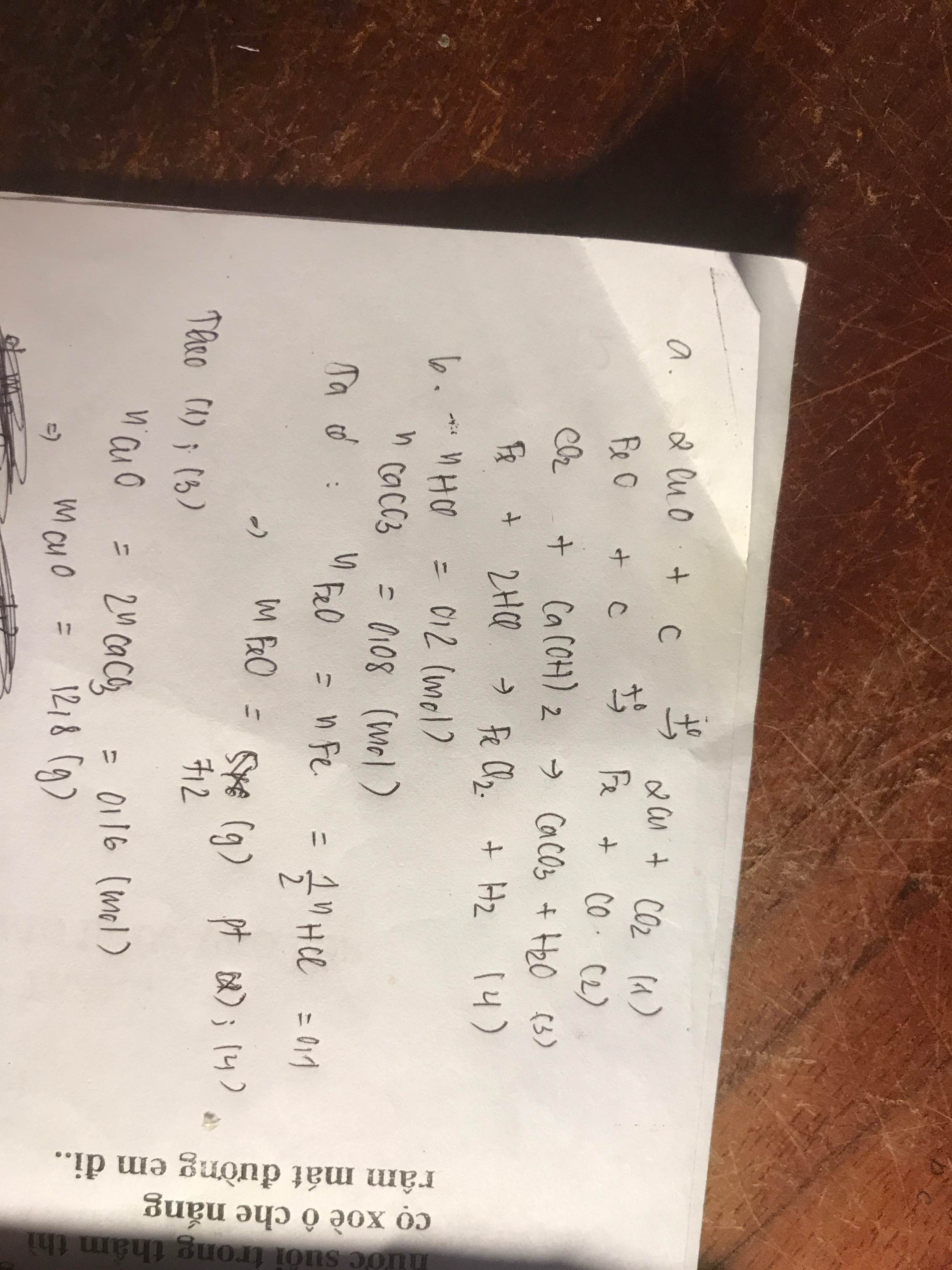
nO2 = 0,1(mol) , nMg = 0,3(mol)
2Mg+ O2 -> 2MgO
0,2......0,1.........0,2 (mol)
Mg+2HCl -> MgCl2 + H2
0,1.....0,2..........0,1.........0,1 (mol)
MgO + 2HCl -> MgCl2 + H2O
0,2.........0,4...........0,2 (mol)
VH2 = 2,24(l)
C%= \(\frac{95.0,3}{7,2+0,1.32+100-0,1.2}\) .100% = 25,86%
nMg = 7.2/24 = 0.3 mol
nO2 = 2.24/22.4 = 0.1 mol
Vì : sau phản ứng thu được hỗn hợp rắn A : Mg, MgO
=> Mg dư
2Mg + O2 -to-> 2MgO
0.2___0.1______0.2
nMg dư = 0.3- 0.2 = 0.1 mol
mA = 0.1*24 + 0.2* 40 = 10.4 g
mHCl = 29.2 g
nHCl = 0.8 mol
Mg + 2HCl --> MgCl2 + H2
0.1___0.2______0.1____0.1
VH2 =2.24 l
MgO + 2HCl --> MgCl2 + H2O
0.2____0.4______0.2
dd C : 0.3 mol MgCl2 , 0.2 mol HCl dư
mdd sau phản ứng = 10.4 + 100 - 0.2 =110.2 g
mMgCl2 = 0.3*95=28.5 g
mHCl dư = 0.2*36.5=7.3 g
C%MgCl2 = 28.5/110.2*100% = 25.86%
C%HCl dư =7.3/110.2*100%=6.62%