Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

FexOy + yCO => (to) xFe + yCO2
nCO = V/22.4 = 4.48/22.4 = 0.2 (mol)
Hỗn hợp khí X gồm: CO2 và COdư
dX/H2 = 20 => X = 20x2 = 40
Theo sơ đồ đường chéo, ta có:
CO = 28; CO2 = 44; X = 40
=> tỉ lệ CO : CO2 = 4/12 = 1/3
\(\frac{CO_{dư}}{CO2}=\frac{1}{3}=\frac{CO_{dư}}{CO_{pứ}}\)
Mà ta có: COdư + COpứ = 0.2 (mol)
Suy ra : COpứ = 0.15 (mol)
=> nFexOy = 0.15/y
Ta có: 56x + 16y = \(\frac{8}{\frac{0.15}{y}}=\frac{160}{3}y\)
=> 56x = 112/3 y => x/y = 2/3
Vậy CT là: Fe2O3.
nCO2 = nCO pứ = 0.15 (mol)
nCO dư = 0.05 (mol)
=> % VCO2 = 0.15x22.4x100/(0.05+0.15)x22.4 =75%

1. Khi cho Fe và Cu vào H2SO4 loãng thì chỉ Fe phản ứng, còn Cu k phản ứn, =>m kết tủa là Cu
nH2=2,24/22,4=0,1
Fe + H2SO4 -----> FeSO4 + H2
0,1-----------------------------------...
=>mFe=0,1.56=5,6g => mCu=10-5,6=4,4g
2>
CaCO3 ---> CaO + CO2
x mol x x
MgCO3 ---> MgO + CO2
y mol y y
x + y = nCO2 = 8,6/22,4 = 0,3839 và 56x = 168 ---> x = 3 mol ---> y < 0
Đề bài sai, bạn xem lại

Gọi số mol Cuo và Fe2O3 lần lượt là a,b
CuO + H2 = Cu + H2O
a a a (mol)
Fe2O3 + 3H2 = 2Fe +3H2O
b 3b 2b (mol)
Ta có hệ phương trình: 80a +160b= 40
64a + 112b= 29,6
=> a= 0,2 (mol) ; b= 0,15 (mol)
Số mol H2 phản ứng : 0,2 + 3 x 0,15= 0,65 (mol)
Số mol H2 đã dùng là: 0,65 : 75 x 100= 0,8 (mol)
Thể tích H2 là 0,8 x 22,4= 17,92 (L)
Khối lượng cu trong hỗn hợp là: 0,2 X 64 = 12,8 (g)
%mCu= 12,8 : 29,6 X 100= 43,2%
%mFe= 100%- 43,2%= 56,8%
có mấy cái gần bằng nha bạn, mình không chắc đúng k thử tham khảo nha

a) FexOy+yCO→xFe+yCO2
b) +) Quy đổi 8g oxit sắt thành 8g (Fe; O). Khi đó, xảy ra phản ứng với CO
CO + O 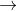 CO2
CO2
=> nCO (phản ứng) = nCO2
+) Lại có: M khí sau phản ứng = 2.d khí/H2 = 40 (g) ≠ MCO2
=> CO còn dư và O phản ứng hết
=> n hh sau = nCO ban đầu =  = 0,2 (mol)
= 0,2 (mol)
=> ∆m = m hh sau – mCO bđ = m Oxi (hh rắn) = 40.0,2 – 28.0,2 = 2,4 (g)
=> nCO2 = nO = 0,15 (mol)
=> mFe = 8 – 2,4 = 5,6 (g)
=> nFe = 0,1 (mol) ; nO = 0,15 (mol)
=> nFe : nO = 2 :3
=> CTPT oxit sắt là Fe2O3
Mặt khác, %V CO2/hh khí sau phản ứng = 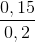 . 100% = 75%
. 100% = 75%
a)FexOy+yCO→xFe+yCO2
b)+) Quy đổi 8g oxit sắt thành 8g (Fe; O). Khi đó, xảy ra phản ứng với CO
CO + O 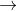 CO2
CO2
=> nCO (phản ứng) = nCO2
+) Lại có: M khí sau phản ứng = 2.d khí/H2 = 40 (g) ≠ MCO2
=> CO còn dư và O phản ứng hết
=> n hh sau = nCO ban đầu =  = 0,2 (mol)
= 0,2 (mol)
=> ∆m = m hh sau – mCO bđ = m Oxi (hh rắn) = 40.0,2 – 28.0,2 = 2,4 (g)
=> nCO2 = nO = 0,15 (mol)
=> mFe = 8 – 2,4 = 5,6 (g)
=> nFe = 0,1 (mol) ; nO = 0,15 (mol)
=> nFe : nO = 2 :3
=> CTPT oxit sắt là Fe2O3
Mặt khác, %V CO2/hh khí sau phản ứng = 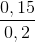 . 100% = 75%
. 100% = 75%

Câu 2: \(Fe_xO_y+yCO\rightarrow xFe+yCO_2\)
______________ 0,2 mol______0,2 mol
_ \(n_{CO}=\dfrac{4,48}{22,4}=0,2mol\)
_ hh khí thu đc (CO dư, CO2 tt)
Gọi a là số mol CO pư (a>0)
=> nCO dư = 0,2 - a (mol)
Vì \(d^{hhkhí}/H_2=20\Rightarrow\overline{M}_X=40\)
\(\Rightarrow\dfrac{28\left(0,2-a\right)+44a}{0,2-a+a}=40\)
\(\Rightarrow a=0,15\)
PTHH: \(Fe_xO_y+yCO\rightarrow xFe+yCO_2\)
\(\dfrac{0,15}{y}\left(mol\right)\)____ 0,15 mol
mà \(n_{Fe_xO_y}=\dfrac{8}{56x+16y}=\dfrac{0,15}{y}\)
\(\Rightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
\(\Rightarrow CTHH:Fe_2O_3\)
\(\Rightarrow\%V_{CO_2}=75\%\)

a) Theo đề bài , ta có:
nFe= \(\frac{m_{Fe}}{M_{Fe}}=\frac{28}{56}=0,5\left(mol\right)\)
PTHH: Fe + 2HCl -> FeCl2 + H2
Theo PTHH: 1:2:1:1 (mol)
Theo đề bài: 0,5:1:0,5:0,5 (mol)
b) Theo PTHH và đề bài, ta có:
\(n_{H_2}=n_{Fe}=0,5\left(mol\right)\)
Thể tích khí H2 thu được (đktc) :
\(V_{H_2\left(đktc\right)}=n_{H_2}.22,4=0,5.22,4=11,2\left(g\right)\)
c) Theo PTHH và đề bài, ta có:
\(n_{FeCl_2}=n_{Fe}=0,5\left(mol\right)\)
Khối lượng FeCl2 thu được:
\(m_{FeCl_2}=n_{FeCl_2}.M_{FeCl_2}=0,5.127=63,5\left(g\right)\)

\(1.\\ PTHH:Fe_2O_3+3CO\underrightarrow{t^o}2Fe+3CO_2\\ n_{Fe}=\frac{16,8}{56}=0,3\left(mol\right)\\ m_{Fe_2O_3}=0,15.160=24\left(g\right)\\ m_{CO}=0,45.28=12,6\left(g\right)\\ V_{CO_2}=0,45.22,4=10,08\left(l\right)\)
\(2.\\ PTHH:Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\\ n_{H_2SO_4}=1,5\left(mol\right)\Rightarrow\left\{{}\begin{matrix}n_{Al_2O_3}=n_{Al_2\left(SO_4\right)_3}=0,5\left(mol\right)\\n_{H_2O}=1,5\left(mol\right)\end{matrix}\right.\\ m_{Al_2O_3}=0,5.102=51\left(g\right)\\ m_{H_2O}=18.1,5=27\left(g\right)\\ C_1:m_{Al_2\left(SO_4\right)_3}=0,5.342=171\left(g\right)\\ C_2:m_{Al_2\left(SO_4\right)_3}=51+1,5.98-27=171\left(g\right)\)
FexOy + yCO -> xFe + yCO2
Ta có: nCO=4,48/22,4=0,2 mol
Sau phản ứng hỗn hợp khí thu được gồm CO a mol và CO2 b mol
-> nX=nCO ban đầu =0,2 mol =a+b
dX/H2=20 -> MX=20MH2=40
Ta có: mX=40.0,2=8 gam=28a+44b
Giải được: a=0,05; b=0,15 -> nCO2 tạo ra =0,15 mol
% V CO2 trong X=%nCO2 trong X=0,15/0,2=75%
Ta có: nFexOy=nCO2/y=0,15/y
-> M FexOy=56x+16y=8/(0,15/y)=160y/3
-> 56x=112y/3 -> x:y=2:3 -> Fe2O3