Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a,
Gỉa sử hỗn hợp A phản ứng hết với CuSO\(_4\) thì dung dịch sau phản ứng chứa Magie sunfat và sắt (2) sunfat . Sau đó cho NaOH vào để lấy tủa và nung tủa đến khối lượng không đổi thì được rắn gồm Magie oxit và sắt (3) oxit và khối lượng của rắn này phải lớn hơn khối lượng của hỗn hợp A ban đầu
Mà m\(_D\) < m\(_A\) ⇒ ban đầu rắn B có kim loại dư và CuSO\(_4\) phản ứng hết
Do Mg > Fe ⇒ sau khi phản ứng với CuSO\(_4\) thì Fe dư
Đặt a = n\(_{Mg}\) (mol) ; b = n\(_{Fe_{pư}}\)(mol) ; c = n\(_{Fe_{dư}}\) (mol)
ta có phương trình :
24a + 56b + 56c = 5,1 (I)
Mg + CuSO\(_4\) → MgSO\(_4\) + Cu
(mol) a → a → a → a
Fe + CuSO\(_4\) → FeSO\(_4\) + Cu
(mol) b → b → b → b
Rắn B có Cu và Fe dư
ta có m\(_B\) = 64a + 64b + 56c
\(\Leftrightarrow\) 64a + 64b + 56c = 6,9 (II)
dung dịch C chứa FeSO\(_4\) : b (mol) và MgSO\(_4\): a (mol)
NaOH dư + dung dịch C
2NaOH + MgSO\(_4\) → Mg(OH)\(_2\)↓ + Na\(_2\)SO\(_4\)
(mol) a → a
2NaOH + FeSO\(_4\) → Fe(OH)\(_2\) ↓ + Na\(_2\)SO\(_4\)
(mol) b → b
Mg(OH)\(_2\) →t\(^0\) MgO + H\(_2\)O
(mol) a → a
4Fe(OH)\(_2\) + O\(_2\) →t\(^0\) 2Fe\(_2\)O\(_3\) + 4H\(_2\)O
(mol) b → 0,5b
rắn D gồm Fe\(_2\)O\(_3\) và MgO
m\(_D\) = 40a + 160*0,5b
\(\Leftrightarrow\) 40a + 80b = 4,5 (III)
Girai hệ phương trình (I) , (II) và (III) ta được
a = 0,0375 (mol)
b =0,0375 (mol)
c = 0,0375 (mol)
\(\Rightarrow\) \(\Sigma\)n\(_{Fe}\) = b+c = 0,0375 + 0,0375 =0,075 (mol)
⇒ m\(_{Mg}\) = 24*0,0375 = 0,9 (gam)
m\(_{Fe_{bandau}}\) = 56 * 0,075 = 4,2 (gam)
b,
\(\Sigma\)n\(_{CuSO_4}\) = a + b = 0,0375 + 0,0375 = 0,075 (mol)
⇒ C\(_{M_{CuSO_4}}\)= \(\dfrac{0,075}{\dfrac{250}{1000}}\)= 0,3 (M)

2.
a)
+nFe2(SO4)3 = 0.1*2 = 0.2 (mol)
+nBa(OH)2 = 0.15*1.5 = 0.225 (mol)
3Ba(OH)2 + Fe2(SO4)3 => 2Fe(OH)3↓ + 3BaSO4↓(1)
0.225...................0.2.................
2Fe(OH)3(t*) => Fe2O3 + 3H2O(2)
0.15.........................0.075...........
_Dựa vào phương trình (1) ta thấy Fe2(SO4)3 còn dư 0.125 mol => dd(B) : Fe2(SO4)3
Fe2(SO4)3 + 3BaCl2 => 3BaSO4↓ + 2FeCl3
0.125..................0.375............0.375
b)
_Chất rắn (D) : Fe2O3 và BaSO4 không bị phân hủy.
=>m(D) = mFe2O3 + mBaSO4 = 0.075*160 + 0.375*233 = 99.375(g)
_Chất rắn (E) : BaSO4
=>m(E) = mBaSO4 = 0.375*233 = 87.375(g)
c)
_Dung dịch (B) : Fe2(SO4)3
=>Vdd(sau) = 150 + 100 = 250 (ml) = 0.25 (lit)
=>nFe2(SO4)3 (dư) = 0.125 (mol)
=>CM(Fe2(SO4)3) = 0.125 / 0.25 = 0.5 (M)

Cho hỗn hợp X vào dung dịch HCl lấy dư:
PTHH: Al2O3 + 6HCl → 2AlCl3 + 3H2O
MgO + 2HCl → MgCl2 + H2O
Fe + 2HCl → FeCl2 + H2
Dung dịch Y gồm: AlCl3, MgCl2, FeCl2, HCl dư
Khí Z là H2
Chất rắn A là Cu
Cho A tác dụng với H2SO4 đặc nóng.
PTHH: Cu + 2H2SO4(đặc, nóng) → CuSO4 + SO2 + 2H2O
Khí B là SO2
Cho B vào nước vôi trong lấy dư
PTHH: SO2 + Ca(OH)2 → CaSO3 + H2O
Kết tủa D là CaSO3
Cho dung dịch NaOH vào Y tới khi kết tủa lớn nhất thì dừng lại.
PTHH: NaOH + HCl → NaCl + H2O
3NaOH + AlCl3 → Al(OH)3 + 3NaCl
2NaOH + MgCl2 → Mg(OH)2 + 2NaCl
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Chất rắn E là: Al(OH)3, Mg(OH)2, Fe(OH)2
Nung E trong không khí
Chất rắn G là Al2O3, MgO, Fe2O3


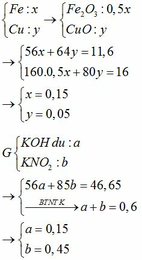
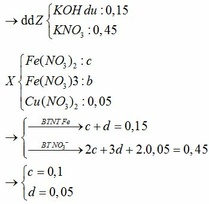

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

C tác dụng với NaOH dư thu được 2 hidroxit kết tủa → C còn 2 muối
→ C còn Fe(NO3)2 và Cu(NO3)2 dư
\(\text{Fe(NO3)2 + 2NaOH → 2NaNO3 + Fe(OH)2↓}\)
\(\text{Cu(NO3)2 + 2NaOH → 2NaNO3 + Cu(OH)2↓}\)
Gọi số mol Fe(OH)2, Cu(OH)2 lần lượt là x, y
4Fe(OH)2 + O2 → 2Fe2O3 + 4H2O
..x............................x/2.............................(mol)
Cu(OH)2 → CuO + H2O
...y...................y...................(mol)
Giải HPT:
\(\left\{{}\begin{matrix}\text{90
x
+
98
y
=
18
,
4
}\\80x+80y=16\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}\text{
x
=
0
,
15}\\y=0,05\end{matrix}\right.\)
Gọi số mol Fe phản ứng với AgNO3, Cu(NO3)2 lần lượt là a, b
\(\text{Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓}\)
a............. 2a..................a.................2a.............(mol)
\(\text{Fe + Cu(NO3)2 → Fe(NO3)2 + Cu↓}\)
b...............b.......................b..............b..............(mol)
mcr = mAg + mCu = 2a.108 + 64b = 216a + 64b = 17,2
\(\text{nFe(NO3)2 = a + b = 0,15 }\)
→ a = 0,05; b = 0,1
a) mFe = (0,05 + 0,1) . 56 = 8,4g
b) nAgNO3 = 2 . 0,05 = 0,1 mol
\(\text{→ CM (AgNO3) = 0,1 : 0,5 = 0,2M}\)
nCu(NO3)2 dư = nCu(OH)2 = 0,05 mol
nCu(NO3)2 = 0,05 + 0,1 = 0,15 mol
\(\text{CM (Cu(NO3)2) = 0,15 : 0,5 = 0,3M}\)

Số mol CuSO4 ban đầu là=100:250 =0,4 mol .Số mol HCl ban đầu =0,36 mol.Vậy mỗi phần có 0,2 mol CuSO4 và 0,12 mol HCl
a)
Số mol Al=0,2 mol.Số mol khí sinh ra là:0,06 mol
Pứ: 2Al + 6HCl ➞ 2AlCl3 + 3H2
0,04 0,12 0,06
Sau pứ này Al còn 0,2-0,04=0,16 mol và phản ứng tiếp với CuSO4 tạo dung dịch B .Dung dịch B tác dụng với xút dư vẫn có kết tủa sauy ra CuSO4 không pứ hết nên còn dư trong dung dịch B .Gọi a là số mol CuSO4 đã phản ứng với Al ta có PT:
2Al + 3CuSO4 ➞ Al2(SO4)3 + 3Cu (3)
2/3a : a (mol)
CuSO4 + 2NaOH ➞ Cu(OH)2 + Na2SO4
(0,2-a) (0,2-a)
Cu(OH)2 ➞ CuO + H2O
(0,2-a) : (0,2-a)
=>0,2-a=0.05=>a=0.15
Vậy lượng chất rắn C=lượng Cu sinh ra ở (3) +lượng Al còn dư =0,15.64+(0.16-2/3*0.15)*27=11.22(g)
Số mol Ba=0,1 mol
Ba+ 2HCl ➞ BaCl2 + H2
0,06 : 0,12 (mol)
Ba còn dư 0,04 mol sẽ phản ứng với tiếp với nước
Ba+ 2H2O ➜ Ba(OH)2 + H2
0,04 : .......... .... 0,04 (mol)
Trong dung dịch khi kết thúc hai pứ trên có số mol Ba2+ = số mol Ba =0,1 mol và số mol OH- =2số mol Ba(OH)2 =0,08 mol
Ba2+ + SO42- ➞ BaSO4 : Cu2+ + 2OH- ➞ Cu(OH)2
0,1 .......(0,2) ...........0,1 ......................0,04 ......0,08 ..........0,04
Chỉ có CuSO4 bị nhiệt phân Cu(OH)2 ➞ CuO + H2O
...................................................0,04........... 0,04
Vậy chất rắn thu đc sau khi nung là=0,1.233+0,04.80=26,5g

\(n_{CuSO_4}=\dfrac{15,2}{160}=0,095mol\\ CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
0,095 0,19 0,095 0,095
\(m_{rắn}=m_{Cu\left(OH\right)_2}=0,095.98=9,31g\\ V_{ddNaOH}=\dfrac{0,19}{2}=0,095l\\ b)C_{M_{Na_2SO_4}}=\dfrac{0,095}{0,04+0,095}\approx0,7M\\ c)Cu\left(OH\right)_2\xrightarrow[t^0]{}CuO+H_2O\)
0,095 0,095
\(m_{rắn}=m_{CuO}=0,095.80=7,6g\)


\(\text{a) Ta có: nCuSO4=8/(64+96)=0,05 mol}\)
\(\text{nNaOH=5/40=0,125 mol}\)
\(\text{Phản ứng: CuSO4 + 2nNaOH -> Cu(OH)2 + Na2SO4}\)
Ta có: nNaOH > 2nCuSO4 -> NaOH dư
-> nCu(OH)2=nCuSO4=0,05 mol
-> mCu(OH)=0,05.(64+34)=4,9 gam
-> mB
\(\text{Nung B: Cu(OH)2 -> CuO + H2O}\)
\(\text{-> nCuO=0,05 mol -> mD=mCuO=4 gam}\)
\(\text{b) Ta có : V dung dịch A=25+75=100 ml =0,1 lít}\)
Dung dịch A chứa Na2SO4 0,05 mol và NaOH dư 0,025 mol
-> CM Na2SO4=0,05/0,1=0,5M;
CM NaOH dư=0,025/0,1=0,25M
\(\text{c) Cu(OH)2 + 2HNO3 -> Cu(NO3)2 + 2H2O}\)
Ta có: nHNO3=2nCu(OH)2=0,1 mol
-> mHNO3=0,1.63=6,3 gam
\(-\text{>m dung dịch HNO3=6,3/6,3%=100 gam}\)