Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có pthh
2Al + 3H2SO4 \(\rightarrow\)Al2(SO4)3 + 3H2
Theo đề bài ta có
nAl=\(\dfrac{10,8}{27}=0,4mol\)
a, Theo pthh
nAl2(SO4)3 =\(\dfrac{1}{2}nAl=\dfrac{1}{2}.0,4=0,2mol\)
\(\Rightarrow\)mAl2(SO4)3=0,2.342=68,4 g
nH2=\(\dfrac{3}{2}nAl=\dfrac{3}{2}.0,4=0,6mol\)
\(\Rightarrow\)VH2=0,6.22,4=13,44 l
b, Khối lượng dd H2SO4 là
mddH2SO4 =\(\dfrac{mct.100\%}{C\%}=\dfrac{10,8.100\%}{10\%}=108g\)
Ta có: \(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
PTHH: 2Al + 3H2SO4 (loãng) -> Al2(SO4)3 + 3H2
Theo PTHH và đề bài, ta có:
\(n_{H_2SO_4}=n_{H_2}=\dfrac{3.n_{Al}}{2}=\dfrac{3.0,4}{2}=0,6\left(mol\right)\)
\(n_{Al_2\left(SO_4\right)_3}=\dfrac{n_{Al}}{2}=\dfrac{0,4}{2}=0,2\left(mol\right)\)
a) Khối lượng muối tạo thành sau phản ứng:
\(m_{Al_2\left(SO_4\right)_3}=0,2.342=68,4\left(g\right)\)
Thể tích khí H2 thoát ra (đktc):
\(V_{H_2\left(đktc\right)}=0,6.22,4=13,44\left(l\right)\)
b) Khối lượng H2SO4:
\(m_{H_2SO_4}=0,6.98=58,8\left(g\right)\)
Khối lượng dung dịch H2SO4 đã dùng:
\(m_{ddH_2SO_4}=\dfrac{m_{H_2SO_4}.100\%}{C\%_{ddH_2SO_4}}=\dfrac{58,8.100}{10}=588\left(g\right)\)

Phương trình: 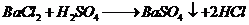
Vậy kết tủa là 

Số mol
Phương trình
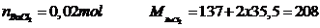

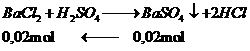
 khối lượng
khối lượng
Vậy m là 

nMg = \(\dfrac{6}{24}=0,25\left(mol\right)\)
Pt: Mg + 2HCl --> MgCl2 + H2
...0,25........0,5......................0,25
VH2 thu được = 0,25 . 22,4 = 5,6 (lít)
mHCl đã dùng = 0,5 . 36,5 = 18,25 (g)
c) nFe2O3 = \(\dfrac{16}{160}=0,1\left(mol\right)\)
Pt: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
...................0,25 mol--> \(\dfrac{0,5}{3}\) mol
Xét tỉ lệ mol giữa Fe2O3 và H2:
\(\dfrac{0,1}{1}>\dfrac{0,25}{3}\)
Vậy Fe2O3 dư
mFe thu được sau pứ = \(\dfrac{0,5}{3}.56=9,33\left(g\right)\)

\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(n_{H2}=0,15\left(mol\right)\)
\(\Rightarrow n_{Al}=0,1\left(mol\right)\)
\(n_{Al2\left(SO4\right)3}=0,05\left(mol\right)\)
\(n_{H2SO4}=0,15\left(mol\right)\)
a,
\(m_{Al}=2,7\left(g\right)\)
\(m_{H2SO4}=14,7\left(g\right)\)
b, \(m_{Al2\left(SO4\right)3}=17,1\left(g\right)\)
a) 2Al+3H2SO4--->Al2(SO4)3+3H2
n H2=3,36/22,4=0,15(mol)
n Al=2/3 n H2=0,1(mol)
m Al=0,1.27=2,7(g)
n H2SO4=n H2=0,15(mol)
m H2SO4=0,15.98=14,7(g)
n Al2(SO4)3=1/3n H2=0,05(mol)
m Al2(SO4)3=0,05.342=17,1(g)

Bài I
1. Lập công thức hoá học của :
a) Nhôm(III) VÀ oxi: Al2O3
b) Natri và nhóm SO4: Na2SO4
c) Bari và nhóm OH: Ba(OH)2
2. Tính phân tử khối của NaOH và FeCl3
+) PTKNaOH = 23 + 16 + 1 = 40đvC
+) PTKFeCl3 = 56 + 3 x 35,5 = 162,5 đvC
Bài II:
1. Tính số mol của 11,2 gam sắt.
=> nFe = \(\frac{11,2}{56}=0,2\left(mol\right)\)
2. Tính số mol của 1,12 lít khí hiđro(đktc)
=> nH2 = \(\frac{1,12}{22,4}=0,05\left(mol\right)\)
3. Tìm khối lượng của 4,8 lít CO2 (đktc)
=> nCO2 = \(\frac{4,8}{22,4}=\frac{3}{14}\left(mol\right)\)
=> mCO2 = \(\frac{3}{14}.44=9,43\left(gam\right)\)
4. Tìm số mol của 11,1 gam CaCl2
=> ncaCl2 = \(\frac{11,1}{111}=0,1\left(mol\right)\)
Bài III
1. PTHH: Fe2O3 + 3H2 =(nhiệt)=> 2Fe + 3H2O
2. Ta có: nFe = \(\frac{16}{160}=0,1\left(mol\right)\)
a) Theo phương trình, nH2 = 0,1 x 3 = 0,3 (mol)
=> VH2(đktc) = \(0,3\times22,4=6,72\left(l\right)\)
b) Theo phương trình, nFe = 0,1 x 2 = 0,2 (mol)
=> mFe = 0,2 x 56 = 11,2 (gam)

n H2 = \(\dfrac{V}{22,4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH:
2Al + 3H2SO4 -----> Al2(SO4)3 + 3H2
2_____3____________1__________3 (mol)
0,1<-------------------0,05<----------0,15 (mol)
khối lượng Al đã phản ứng : mAl = n*M= 0,1*27=2,7(g)
khối lượng Al2(SO4)3 thu được sau phản ứng là:
m = n * M = 0,05*342=17,1(g)
Giải:
a) Số mol của Al tham gia phản ứng là:
\(n_{Al}=\dfrac{m}{M}=\dfrac{4,05}{27}=0,15\left(mol\right)\)
CTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
-----0,15 mol------------------0,075 mol------------
Khối lượng của Al tham gia phản ứng là:
\(m_{Al}=n.M=0,15.27=4,05\left(g\right)\)
Lưu ý: Phần này đề bài đã cho nên mình nghĩ là đề sai nhé! Nhưng mình vẫn giải ra để bạn hiểu cách làm nhé!
b) Khối lượng của Al2(SO4)3 sau phản ứng là:
\(m_{Al_2\left(SO_4\right)_3}=n.M=0,075.342=25,65\left(g\right)\)
Đáp số: ...
Chúc bạn học tốt!!!

Zn+H2SO4->ZnSO4+H2
Fe+H2SO4->FeSO4+H2
gọi nZn là x->nH2SO4(1)=x(mol)
nFe là y->nH2SO4(2)=y(mol)
nH2SO4=1(mol)
Ta có:65x+56y=37.2
=>65x+65y<37.2
-> x+y< xấp xỉ 0.6(mol)
Mà theo đề bài,nH2SO4=1(mol)
->hỗn hợp tan hết,axit dư
Zn+H2SO4->ZnSO4+H2
Fe+H2SO4->FeSO4+H2
gọi nZn là x->nH2SO4(1)=x(mol)
nFe là y->nH2SO4(2)=y(mol)
nH2SO4=1(mol)
Ta có:65x+56y=37.2
=>65x+65y>37.2
-> x+y>xấp xỉ 0.6(mol)
56x+56y<37.2
->x+y<0.7
->0.6<x+y<0.7
mà nH2SO4 theo đề bài là 1mol
->hỗn hợp tan hết,axit dư ^^ xin lỗi bạn phần trước mình làm sai

Pt: 2Al + 6HCl --> 2AlCl3 + 3H2
0,2 mol------------> 0,2 mol--> 0,3 mol
nAl = \(\dfrac{5,4}{27}=0,2\) mol
mAlCl3 = 0,2 . 133,5 = 26,7 (g)
VH2 = 0,3 . 22,4 = 6,72 (lít)
Pt: 2H2 + O2 --to--> 2H2O
0,3 mol--> 0,15 mol
VO2 cần dùng =0,15 . 22,4 = 3,36 (lít)
Mà: Vkk = 5VO2 = 5 . 3,36= 16,8 (lít)
nAl=5,4/27=0,2(mol)
pt: 2Al+6HCl--->2AlCl3+3H2
Theo pt:
nAlCl3=nAl=0,2(mol)
=>mAlCl3=0,2.133,5=26,7(g)
Theo pt: nH2=3/2nAl=3/2.0,2=0,3(mol)
=>VH2=0,3.22,4=6,72(l)
2H2+O2--t*->2H2O
nO2=1/2nH2=1/2.0,3=0,15(mol)
=>V=0,15.22,4=3,36(l)
Ta có nFe = \(\dfrac{22,4}{56}\) = 0,4 ( mol )
nH2SO4 = \(\dfrac{24,5}{98}\) = 0,25 ( mol )
Fe + H2SO4 \(\rightarrow\) FeSO4 + H2
0,4....0,25
=> Lập tỉ số \(\dfrac{0,4}{1}:\dfrac{0,25}{1}\) = 0,4 > 0,25
=> Sau phản ứng Fe còn dư ; H2SO4 hết
=> VH2 = 22,4 . 0,25 = 5,6 ( lít )
=> mFeSO4 = 0,25 . 152 = 38 ( gam )