Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


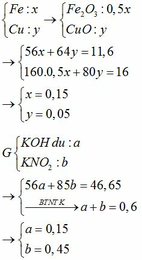
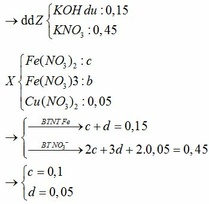

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

Hỗn hợp 2 KL gồm: Ag và Cu dư.
PT: \(Zn+2AgNO_3\rightarrow Zn\left(NO_3\right)_2+2Ag\)
\(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\)
\(Zn\left(NO_3\right)_2+2KOH\rightarrow2KNO_3+Zn\left(OH\right)_2\)
\(Cu\left(NO_3\right)_2+2KOH\rightarrow2KNO_3+Cu\left(OH\right)_2\)
\(Zn\left(OH\right)_2+2KOH\rightarrow K_2ZnO_2+2H_2O\)
\(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
Chất rắn thu được sau pư là CuO.
Ta có: \(n_{AgNO_3}=0,4.1=0,4\left(mol\right)\)
Theo PT: \(n_{Ag}=n_{AgNO_3}=0,4\left(mol\right)\)
Mà: mAg + mCu dư = 49,6 (g)
⇒ mCu (dư) = 49,6 - 0,4.108 = 6,4 (g)
Ta có: 65nZn + 64nCu (pư) = 19,3 - 6,4 (1)
Theo PT: \(n_{AgNO_3}=2n_{Zn}+2n_{Cu\left(pư\right)}=0,4\left(2\right)\)
Từ (1) và (2) ⇒ nZn = nCu (pư) = 0,1 (mol)
Theo PT: \(n_{CuO}=n_{Cu\left(OH\right)_2}=n_{Cu\left(NO_3\right)_2}=n_{Cu\left(pư\right)}=0,1\left(mol\right)\)
⇒ m = mCuO = 0,1.80 = 8 (g)

Tính toán theo PTHH :
Mg + CuSO4 → Cu + MgSO4
Mg + FeSO4 → Fe + MgSO4
Ba(OH)2 + MgSO4 → BaSO4 + Mg(OH)2
Ba(OH)2 + FeSO4 → BaSO4 + Fe(OH)2
Mg(OH)2 → MgO + H2O
2 Fe(OH)2 + ½ O2 → Fe2O3 + 2 H2O
Giả sư dung dịch muối phản ứng hết
=> n Fe = n FeSO4 = 0,2 . 1= 0,2 mol => m Fe = 0,2 . 56 = 11,2 g
=> n Cu =n CuSO4 = 0,2 . 0,5 = 0,1 mol => m Cu = 0,1 . 64 = 6,4 g
=> m chất rắn = 11,2 + 6,4 = 17,6 g > 12 g > 6,4
=> kim loại Fe dư sau phản ứng Vì CuSO4 phản ứng trước sau đó mới đến FeSO4 phản ứng
CuSO4 đã hết và phản ứng với 1 phần FeSO4
12 g = m Cu + m Fe phản ứng = 6,4 g + m Fe phản ứng
=> m Fe = 5,6 g => n Fe = 0,1 mol => n FeSO4 dư = 0,2 – 0,1 = 0,1 mol
Theo PTHH : n Mg = 0,1 + 0,1 = 0,2 mol ( bắng số mol CuSO4 và FeSO4 phản ứng )
Theo PTHH : n Mg = n MgSO4 = n Mg(OH)2 = n MgO = 0,2 mol
n FeSO4 dư = n Fe(OH)2 = n Fe2O3 . 2 = 0,1 mol
=> n Fe2O3 = 0,1 mol
=> m chất rắn = m Fe2O3 + m MgO = 0,1 . 160 + 0,2 . 40 = 24 g

\(n_{Fe}=\dfrac{2,8}{56}=0,05mol\)
\(n_{Al}=\dfrac{0,81}{27}=0,03mol\)
\(B:8,12g\left\{{}\begin{matrix}Cu:a\left(mol\right)\\Ag:b\left(mol\right)\\Fe:c\left(mol\right)\end{matrix}\right.\Rightarrow64a+108b+56c=8,12\)(*)
\(n_{H_2}=\dfrac{0,672}{22,4}=0,03mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,03 0,03
\(\Rightarrow c=n_{Fe}=0,03mol\)
Thay vào (*) ta được: \(64a+108b=8,12-0,03\cdot56\left(1\right)\)
\(n_{Fepư}=0,05-0,03=0,02mol\)
\(BTe:2n_{Cu}+n_{Ag}=3n_{Fepư}+2n_{H_2}\)
\(\Rightarrow2a+b=2\cdot0,02+3\cdot0,03\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,05\\b=0,03\end{matrix}\right.\)
\(C_{M_{Cu\left(NO_3\right)_2}}=\dfrac{0,05}{0,1}=0,5M\)
\(C_{M_{AgNO_3}}=\dfrac{0,03}{0,1}=0,3M\)





Phản ứng nung kết tủa chỉ thu đc một oxit. Vậy Al đẩy hết Ag và đẩy được Cu hoặc ko. Oxit đó là CuO.
\(\rightarrow n_{CuO}=n_{Cu\left(NO3\right)2_{du}}=0,03\left(mol\right)\)
\(n_{Al}=0,08\left(mol\right)\)
Gọi a là mol AgNO3.
- Giả sử Al đẩy vừa đủ Ag, ko đẩy Cu. Khi đó A gồm Ag
\(Al+3AgNO_3\rightarrow Al\left(NO_3\right)_3+3Ag\)
\(\rightarrow n_{Ag}=0,24\left(mol\right)\rightarrow m_{Ag}=25,92\left(g\right)\) (loại)
- Giả sử Al đẩy hết Ag; đẩy một phần Cu.
\(Al+3AgNO_3\rightarrow Al\left(NO_3\right)_3+3Ag\)
\(\rightarrow n_{Ag}=n_{AgNO3}=a\left(mol\right);n_{Al_{pu}}=\frac{a}{3}\left(mol\right)\)
\(n_{Al.day.Cu}=0,08-\frac{a}{3}=\frac{0,24-a}{3}\)
\(2Al+3Cu\left(NO_3\right)_2\rightarrow2Al\left(NO_3\right)_3+3Cu\)
\(\rightarrow n_{Cu}=\frac{0,24-a}{3}\left(mol\right)\) = nCu(NO3)2 phản ứng
\(m_A=12,24\rightarrow108a+32\left(0,24-a\right)=12,24\)
\(\Leftrightarrow a=0,06\)
\(\rightarrow n_{AgNO3}=0,06\left(mol\right);n_{Cu\left(NO3\right)2_{pu}}=0,09\left(mol\right)\)
\(\Rightarrow n_{Cu\left(NO3\right)2_{ban.dau}}=0,09+0,03=0,12\left(mol\right)\)
\(CM_{AgNO3}=\frac{0,06}{0,2}=0,3M\)
\(CM_{Cu\left(NO3\right)2}=\frac{0,12}{0,2}=0,6M\)