Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vì sản phẩm khử của H2SO4 đặc có nhiều dạng như SO2, S, H2S nên bài toán sử dụng cách truyền thống (viết phương trình, cân bằng và đặt ẩn) sẽ không khả thi. Vì vậy sử dụng định luật bảo toàn là cách hợp lí.
Gọi sản phẩm khử là X và k là số electron mà H2SO4 nhận để tạo ra X.
Sơ đồ phản ứng:
Al+H2SO4 đặc->Al2(SO4)3+X+H2O
![]()
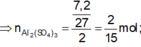
![]()
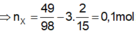


\(m_X=56x+64y+108x=29.2\left(g\right)\)
\(\Rightarrow164x+64y=29.2\left(1\right)\)
\(n_{H_2SO_4}=\dfrac{80\cdot98\%}{98}=0.8\left(mol\right)\)
Bảo toàn e :
\(3n_{Fe}+2n_{Cu}+n_{Ag}=2n_{SO_2}\)
\(\Rightarrow n_{SO_2}=2x+y\left(mol\right)\)
Bảo toàn S :
\(n_{H_2SO_4}=3n_{Fe_2\left(SO_4\right)_3}+n_{CuSO_4}+n_{Ag_2SO_4}+n_{SO_2}\)
\(\Rightarrow x+y+x+2x+y=0.8\)
\(\Rightarrow4x+2y=0.8\left(2\right)\)
\(\left(1\right),\left(2\right):x=0.1,y=0.2\)

Đáp án D
Số mol các chất là:
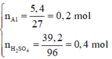
Sơ đồ phản ứng:
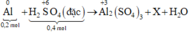
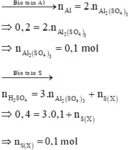
Gọi k là số electron trao đổi tạo ra S trong X
Các quá trình nhường, nhận electron:


Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\\n_{Cu}=c\left(mol\right)\\n_{Al}=d\left(mol\right)\end{matrix}\right.\)
_ Khi tác dụng với HCl.
Ta có: \(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
Theo ĐLBT mol e, có: 2a + 2b + 3d = 0,45.2 ⇒ 2a + 2b + 3d = 0,9 (1)
_ Khi tác dụng với H2SO4 đặc nóng.
Ta có: \(n_{SO_2}=\dfrac{10,64}{22,4}=0,475\left(mol\right)\)
Theo ĐLBT mol e, có: 2a + 2b + 2c + 3d = 0,475.2
⇒ 2a + 2b - 2c + 3d = 0,95 (2)
Trừ 2 vế của (1) và (2), có: c = 0,025 (mol)
\(\Rightarrow\%m_{Cu}=\dfrac{0,025.64}{14,7}.100\%\approx10,88\%\)
Bạn tham khảo nhé!
Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\\n_{Cu}=c\left(mol\right)\\n_{Al}=d\left(mol\right)\end{matrix}\right.\)
Ta có: \(\left\{{}\begin{matrix}n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\\n_{SO_2}=\dfrac{10,64}{22,4}=0,475\left(mol\right)\end{matrix}\right.\)
Bảo toàn electron: \(\left\{{}\begin{matrix}2a+2b+2c+3d=0,475\cdot2\\2a+2b+3d=0,45\cdot2\end{matrix}\right.\)
\(\Rightarrow2c=0,475\cdot2-0,45\cdot2=0,05\) \(\Rightarrow c=0,025\)
\(\Rightarrow\%m_{Cu}=\dfrac{0,025\cdot64}{14,7}\cdot100\%\approx10,88\%\)

\(n_{H_2} = \dfrac{6,72}{22,4} = 0,3(mol)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ n_{Al} = \dfrac{2}{3}n_{H_2} = 0,2(mol)\\ 2Al + 6H_2SO_4 \to Al_2(SO_4)_3 + 3SO_2 + 6H_2O\\ Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + 2H_2O\\ n_{SO_2} = \dfrac{8,96}{22,4} = 0,4(mol)\\ \Rightarrow \dfrac{3}{2}n_{Al} + n_{Cu} = 0,4\\ \Rightarrow n_{Cu} = 0,1(mol)\\ \Rightarrow m = 0,2.27 + 0,1.64 = 11,8(gam)\)

Mgo → Mg+2 + 2e
S+6 (6−x)e → S+x
nMg = 2,88/24 = 0,12mol
nB = 0,672/22,4 = 0,03mol
Áp dụng bảo toàn e :
<=> 0,12.2 = 0,03.(6−x)
=> x = −2
Vậy CTPT của khí B là là H2S

công thức oxit của sắt : Fe2Oy
nSO2=0,075 mol
2FexOy + (6x-2y)H2SO4 ---> xFe2(SO4)3 + (3x-2y)SO2 + (6x-2y)H2O
0,25 mol..........................................0,075 mol
theo pt trên ta có
\(\frac{0,25.2}{6x-2y}=\frac{0,075.2}{3x-2y}\)
<=> 0,75x-0,5y=0,45x-0,15y
<=>0,3x=0,35y<=> \(\frac{x}{y}=\frac{0,35}{0,3}=\frac{7}{6}\)
=> oxit sắt là Fe7O6
sao bạn lại để đấp án oxit fe như vậy làm j có công thức oxit fe đó
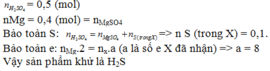
nZn=0,3 mol; \(n_{H_2SO_4} = 0,4 mol\)
\(\begin{array}{l} Zn \to Z{n^{2 + }} + 2{\rm{e}}\\ 0,3\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,6\,mol \end{array} \)
Bảo toàn S: \({n_{\mathop S\limits^x }} = {n_{{H_2}S{O_4}}} - {n_{Zn{\rm{S}}{O_4}}} = 0,4 - 0,3 = 0,1\,mol\)
\(\begin{array}{l} \mathop S\limits^{ + 6} \, + \,(6 - x)e \to \mathop S\limits^x \\ 0,1\,\,\,\,\,\,\,\,\,0,6\,mol \end{array}\)
\(\rightarrow x=0\)
\(\rightarrow\) Sản phẩm khử là S.