Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nZn=39:65=0,6mol
mHCl=\(\frac{100}{100}.29,2=29,2g\)=>nHCl=29,2:36,5=0,8mol
PTHH: Zn+2HCl=>ZnCl2+H2
0,6 : 0,8 =>nZn dư theo nHCl
p/ư: 0,4mol<-0,8mol->0,4mol->0,4mol
=> mZnCl2=0,4.136=54,4g
mH2=0,4.2=0,8g
sau phản ứng Zn dư
khối lượng Zn dư là : m=(0,6-0,4).65=13g
Zn+2HCl-->ZnCl2+H2
Khối lượng của HCl là
mct=(mdd.C%):100%
=(100.29,2%):100%
=29,2(g)
Số mol của HCl là
n=m/M=29,2/36,5
=0,8(mol)
Số mol của Zn là
n=m/M=39/65=0,6(mol)
So sánh
nZn bđ/pt=0,6/2>
nHCl bđ/pt=0,8/2
->Zn dư tính theo HCl
Số mol của ZnCl2 là
nZnCl2=1/2nHCl
=1/2.0,8=0,4(mol)
Khối lượng của ZnCl2 là
m=n.M=0,4.136=54,4(g)
Số mol của H2 là
nH2=1/2nHCl=0,4(mol)
Khối lượng của H2 là
m=n.m=0,4.2=0,8(g)
Sau phản ứng Zn dư
Số mol Zn phản ứng là
nZn=1/2nHCl=1/2.0,8
=0,4(mol)
Khối lượng Zn dư là
m=n.M=(0,6-0,4).65=13(g)

a)
\(Zn + 2HCl \to ZnCl_2 + H_2\)
b)
\(n_{Zn} = \dfrac{13}{65} = 0,2(mol)\)
Ta thấy : \(\dfrac{n_{Zn}}{1} = 0,2 > \dfrac{n_{HCl}}{2} = 0,15\) nên Zn dư.
Theo PTHH :
\(n_{Zn\ pư} = 0,5n_{HCl} = 0,15(mol)\\ \Rightarrow n_{Zn\ dư} = 0,2 - 0,15 = 0,05(mol)\\ \Rightarrow m_{Zn\ dư} = 0,05.65 = 3,25(gam)\)
c)
Ta có :
\(n_{H_2} = n_{Zn\ pư} = 0,15(mol)\\ \Rightarrow V_{H_2} = 0,15.22,4 = 3,36(lít)\)

\(a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right);n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\\ LTL:\dfrac{0,2}{1}< \dfrac{0,5}{2}\Rightarrow HCldư\\ n_{HCl\left(pứ\right)}=2n_{Zn}=0,4\left(mol\right)\\\Rightarrow m_{HCl\left(dư\right)}=\left(0,5-0,4\right).36,5=3,65\left(g\right)\\ b.n_{ZnCl_2}=n_{Zn}=0,2\left(mol\right)\\ \Rightarrow m_{ZnCl_2}=0,2.136=27,2\left(g\right)\\ c.n_{H_2}=n_{Zn}=0,2\left(mol\right)\\ \Rightarrow V_{H_2}=0,2.22,4,=4,48\left(l\right)\\ d.3H_2+Fe_2O_3-^{t^o}\rightarrow2Fe+3H_2O \\ n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12\left(mol\right)\\ LTL:\dfrac{0,2}{3}< \dfrac{0,12}{1}\Rightarrow Fe_2O_3dưsauphảnứng\\ \Rightarrow n_{Fe}=\dfrac{2}{3}n_{H_2}=\dfrac{2}{15}\left(mol\right)\\ \Rightarrow m_{Fe}=\dfrac{2}{15}.56=7,467\left(g\right)\)
a) n\(Zn\)=\(\dfrac{m}{M}\)=\(\dfrac{13}{65}\)=0,2(mol)
n\(HCl\)=\(\dfrac{m}{M}\)=\(\dfrac{18,25}{36,5}=\)0,5(mol)
PTHH : Zn + 2HCl->ZnCl\(2\) + H\(2\)
0,2 0,5
Lập tỉ lệ mol : \(^{\dfrac{0,2}{1}}\)<\(\dfrac{0,5}{2}\)
n\(Zn\) hết , n\(HCl\) dư
-->Tính theo số mol hết
Zn + 2HCl->ZnCl\(2\) + H\(2\)
0,2 -> 0,4 0,2 0,2
n\(HCl\) dư= n\(HCl\)(đề) - n\(HCl\)(pt)= 0,5 - 0,4 = 0,1(mol)
m\(HCl\) dư= 0,1.36,5 = 3,65(g)
b) m\(ZnCl2\) = n.M= 0,2.136= 27,2 (g)
c)V\(H2\)=n.22,4=0,2.22,4=4,48(l)
d) n\(Fe\)\(2\)O\(3\)=\(\dfrac{m}{M}\)=\(\dfrac{19,2}{160}\)=0,12 (mol)
3H2 +Fe2O3 → 2Fe + 3H2O
0,2 0,12
Lập tỉ lệ mol: \(\dfrac{0,2}{3}\)<\(\dfrac{0,12}{1}\)
nH2 hết .Tính theo số mol hết
\(HCl\)
3H2 +Fe2O3 → 2Fe + 3H2O
0,2-> 0,2
m\(Fe\)=n.M= 0,2.56= 11,2(g)

a. \(n_{Zn}=\dfrac{19.5}{65}=0,3\left(mol\right)\)
\(n_{HCl}=\dfrac{14.6}{36.5}=0,4\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,4 0,2 0,2
Ta thấy : \(\dfrac{0.3}{1}>\dfrac{0.4}{2}\) => Zn dư , HCl đủ
b. \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
c. \(m_{ZnCl_2}=0,2.136=27,2\left(g\right)\)
a) Zn + 2HCl --> ZnCl2 + H2 ↑ (1)
0,3 -->0,15 -->0,15 (mol)
nZn= 19,5/65 = 0,3 mol
nHCl= 14,5/37,5 = 0,3 mol
Ta có : nZn bài ra / nZn phương trình=0,3/1=0,3 (mol)
nHCl bài ra / nHCl phương trình=0,3/2=0,15 (mol)
=> HCl đủ,Zn dư
b) Theo PT(1) => nH2=0,15(mol)
=>VH2=0,15 x 22,4 = 3,36(l)
c) Theo PT(1) => nZnCl2=0,15(mol)
=>mZnCl2=0,15 x 136 = 20,4(g)

a) PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
b) Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{32,5}{65}=0,5\left(mol\right)\\n_{HCl}=\dfrac{3,65}{36,5}=0,1\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,5}{1}>\dfrac{0,1}{2}\) \(\Rightarrow\) HCl phản ứng hết, Zn còn dư
\(\Rightarrow n_{Zn\left(dư\right)}=0,5-0,05=0,45\left(mol\right)\) \(\Rightarrow m_{Zn\left(dư\right)}=0,45\cdot65=29,25\left(g\right)\)
c+d) Theo PTHH: \(n_{ZnCl_2}=n_{H_2}=\dfrac{1}{2}n_{HCl}=0,05mol\)
\(\Rightarrow\left\{{}\begin{matrix}m_{ZnCl_2}=0,05\cdot136=6,8\left(g\right)\\V_{H_2}=0,05\cdot22,4=1,12\left(l\right)\end{matrix}\right.\)

\(n_{Mg}=\dfrac{2.4}{24}=0.1\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(0.1....................................0.1\)
\(V_{H_2}=0.1\cdot22.4=2.24\left(l\right)\)
\(2H_2+O_2\underrightarrow{^{t^0}}2H_2O\)
\(0.1.....0.05\)
\(m_{O_2\left(dư\right)}=\left(0.5-0.05\right)\cdot32=14.4\left(g\right)\)

\(n_{Zn}=\dfrac{13}{65}=0,2mol\)
\(n_{HCl}=\dfrac{18,25}{36,5}=0,5mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,5 0 0
0,2 0,4 0,2 0,2
0 0,1 0,2 0,2
Sau phản ứng, axit HCl còn dư và dư \(m=0,1\cdot36,5=3,65g\)
\(m_{ZnCl_2}=0,2\cdot136=27,2g\)
\(V_{H_2}=0,2\cdot22,4=4,48l\)

nFe = 2.8/56 = 0.05 (mol)
nHCl = 14.6/36.5 = 0.4 (mol)
Fe + 2HCl => FeCl2 + H2
1.........2
0.05......0.4
LTL : 0.05/1 < 0.4/2
=> HCl dư
mHCl (dư) = ( 0.4 - 0.1 ) * 36.5 = 10.95 (g)
VH2 = 0.05*22.4 = 1.12 (l)
nHCl (dư) = 0.4 - 0.1 = 0.3 (mol)
mFe cần thêm = 0.3/2 * 56 = 8.4 (g)

\(a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ b.n_{Zn}=n_{ZnCl_2}=0,1\left(mol\right)\\ \Rightarrow m_{ZnCl_2}=0,1.136=13,6\left(g\right)\\ c.n_{H_2}=n_{Zn}=0,1\left(mol\right)\\ \Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
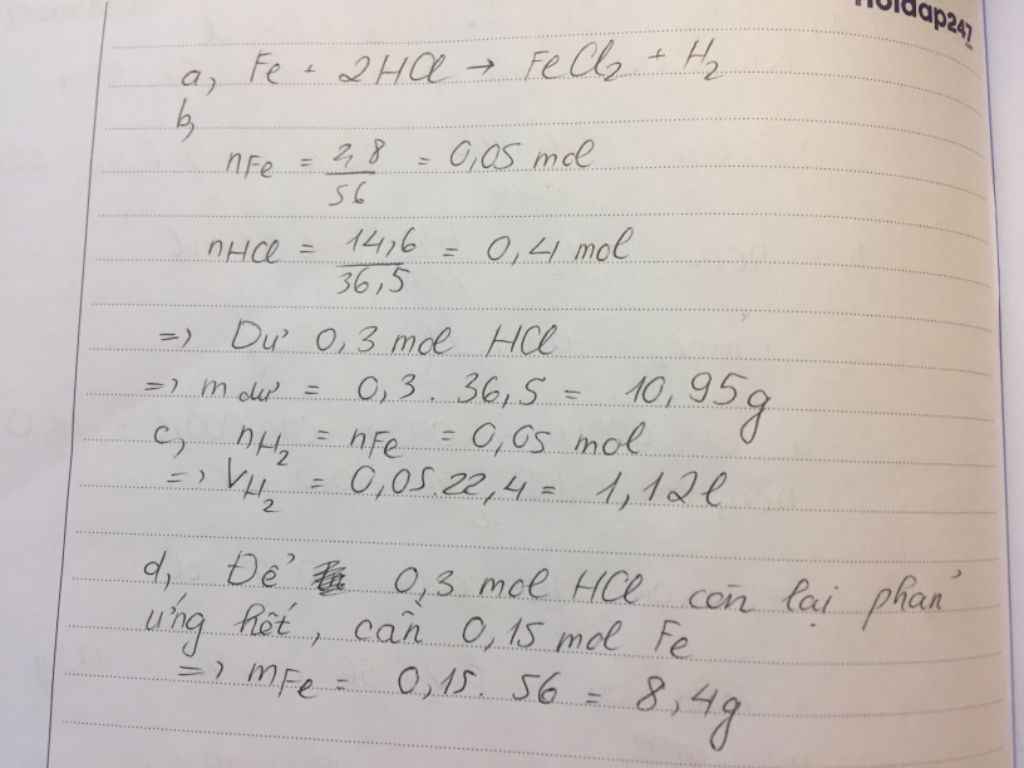
\(a,PTHH:Zn+2HCl\to ZnCl_2+H_2\\ b,n_{Zn}=\dfrac{13}{65}=0,2(mol)\)
Vì \(\dfrac{n_{Zn}}{1}>\dfrac{n_{HCl}}{2}\) nên Zn dư
\(\Rightarrow n_{Zn({\text{phản ứng})}}=\dfrac{1}{2}n_{HCl}=0,15(mol)\\ \Rightarrow n_{Zn(\text{dư})}=0,2-0,15=0,05(mol)\\ \Rightarrow m_{Zn(\text{dư})}=0,05.65=3,25(g)\\ c,n_{ZnCl_2}=n_{H_2}=\dfrac{1}{2}n_{HCl}=0,15(mol)\\ \Rightarrow a=m_{ZnCl_2}=0,15.136=20,4(g)\\ V=V_{H_2}=0,15.22,4=3,36(l)\)
3,36