Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a) Fe + 2HCl \to FeCl_2\\ b) n_{HCl} = \dfrac{182,5.5\%}{36,5} = 0,25(mol)\\ n_{FeCl_2} = n_{H_2} = n_{Fe} = \dfrac{1}{2}n_{HCl} = 0,125(mol)\\ \Rightarrow m_{Fe} = 0,125.56 = 7(gam) ; V = 0,125.22,4 = 2,8(lít)\\ c) m_{dd\ sau\ phản\ ứng} = m_{Fe} + m_{dd\ HCl} - m_{H_2} = 7 + 182,5 - 0,125.2 = 189,25(gam)\\ C\%_{FeCl_2} = \dfrac{0,125.127}{189,25}.100\% = 8,39\%\)

nH2 = VH2 : 22,4 = 3,36 : 22,4 = 0,15 mol
PTHH: 2Al + 6HCl → 2AlCl3 + 3H2
Tỉ lệ: 2 3
Pứ: ? mol 0,15
Từ pthh ta có nAl = 2/3 nH2 = 2/3 . 0,15 = 0,1 mol
=> mAl = nAl . MAl = 0,1 . 27 = 2,7g

\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
=> nHCl = 0,8 (mol)
Theo ĐLBTKL: mA,B + mHCl = mmuối + mH2
=> mA,B = 39,4 + 0,4.2 - 0,8.36,5 = 11 (g)

Fe+2HCl->FeCl2+H2
0,125--0,25---0,125-0,125
m HCl=9,125 g=>n HCl=\(\dfrac{9,125}{26,5}\)=0,25 mol
=>m Fe=0,125.56=7g
=>VH2=0,125.22,4=2,8l
=>C%FeCl2=\(\dfrac{0,125.127}{7+182,5-0,25}\).100=8,388%

a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
b, Ta có: \(n_{HCl}=0,5.0,2=0,1\left(mol\right)\)
\(n_{H_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\)
Theo PT: \(n_{HCl\left(pư\right)}=2n_{H_2}=0,08\left(mol\right)< 0,1\left(mol\right)\)
→ HCl dư.
Gọi: \(\left\{{}\begin{matrix}n_{Zn}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
Theo PT: \(n_{H_2}=n_{Zn}+n_{Fe}=x+y=0,04\left(1\right)\)
\(\left\{{}\begin{matrix}n_{ZnCl_2}=n_{Zn}=x\left(mol\right)\\n_{FeCl_2}=n_{Fe}=y\left(mol\right)\end{matrix}\right.\)⇒ 136x + 127y = 5,26 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,02\left(mol\right)\\y=0,02\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,02.65}{0,02.65+0,02.56}.100\%\approx53,72\%\\\%m_{Fe}\approx46,28\%\end{matrix}\right.\)

a) \(\left\{{}\begin{matrix}n_{HCl}=0,5.1=0,5\left(mol\right)\\n_{H_2SO_4}=0,5.0,28=0,14\left(mol\right)\end{matrix}\right.\)
=> \(n_H=0,5+0,14.2=0,78\left(mol\right)\)
\(n_{H_2}=\dfrac{8,736}{22,4}=0,39\left(mol\right)\)
Do \(n_{H_2}=2.n_H\)
=> Lượng axit pư hết
BTKL: \(m_{KL}+m_{HCl}+m_{H_2SO_4}=m_{muối}+m_{H_2}\)
=> mmuối = 7,74 + 0,5.36,5 + 0,14.98 - 0,39.2
= 38,93 (g)
b)
Gọi \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\)
=> 24a + 27b = 7,74 (1)
PTHH: Mg + 2HCl --> MgCl2 + H2
Mg + H2SO4 --> MgSO4 + H2
2Al + 6HCl --> 2AlCl3 + 3H2
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
=> \(n_{H_2}=n_{Mg}+1,5.n_{Al}\)
=> a + 1,5b = 0,39 (2)
(1)(2) => a = 0,12 (mol); b = 0,18 (mol)
Kết tủa lớn nhất khi Mg2+, Al3+ bị kết tủa hoàn toàn và không có sự hòa tan kết tủa
\(\left\{{}\begin{matrix}n_{Mg\left(OH\right)_2}=0,12\left(mol\right)\\n_{Al\left(OH\right)_3}=0,18\left(mol\right)\end{matrix}\right.\)
=> mkt = 0,12.58 + 0,18.78 = 21 (g)
Bảo toàn (OH): nNaOH = 0,12.2 + 0,18.3 = 0,78 (mol)
=> \(V_{dd.NaOH}=\dfrac{0,78}{2}=0,39\left(l\right)\)

a)
2Al + 6HCl --> 2AlCl3 + 3H2
Fe + 2HCl --> FeCl2 + H2
b)Gọi số mol Al, Fe là a, b (mol)
=> 27a + 56b = 11 (1)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a--->3a-------->a------>1,5a
Fe + 2HCl --> FeCl2 + H2
b---->2b------>b---->b
=> \(n_{H_2}=1,5a+b=\dfrac{8,96}{22,4}=0,4\left(mol\right)\) (2)
(1)(2) => a = 0,2; b = 0,1
mHCl = (0,6 + 0,2).36,5 = 29,2 (g)
=> \(m_{ddHCl}=\dfrac{29,2.100}{9,125}=320\left(g\right)\)
mdd sau pư = 11 + 320 - 0,4.2 = 330,2 (g)
\(\left\{{}\begin{matrix}C\%_{AlCl_3}=\dfrac{0,2.133,5}{330,2}.100\%=8,086\%\\C\%_{FeCl_2}=\dfrac{0,1.127}{330,2}.100\%=3,846\%\end{matrix}\right.\)
Đặt: nAl = a (mol); nFe = b (mol)
27a + 56b = 11 (g) (1)
nH2 = 8,96/22,4 = 0,4 (mol)
PTHH:
2Al + 6HCl -> 2AlCl3 + 3H2
Mol: a ---> 3a ---> a ---> 1,5a
Fe + 2HCl -> FeCl2 + H2
Mol: b ---> 2b ---> b ---> b
nH2 = 1,5a + b = 0,4 (mol)
Từ (1)(2) <=> a = 0,2 (mol); b = 0,1 (mol)
Còn C% bạn tự tính

\(BTKL:\)
\(m_{O_2}=34-20.4=13.6\left(g\right)\)
\(n_{O_2}=\dfrac{13.6}{32}=0.425\left(mol\right)\)
\(BTNTO:\)
\(n_{H_2O}=2n_{O_2}=2\cdot0.425=0.85\left(mol\right)\)
\(BTNTH:\)
\(n_{HCl}=2n_{H_2O}=2\cdot0.85=1.7\left(mol\right)\)
\(m_{Muối}=m_{Kl}+m_{Cl^-}=20.4+1.7\cdot35.5=80.75\left(g\right)\)

Xét TN1:
PTHH: Fe + 2HCl FeCl2 + H2 (1)
Giả sử: Fe phản ứng hết Chất rắn là FeCl2
*Xét TN2:
PTHH: Mg + 2HCl MgCl2 + H2 (2)
Fe + 2HCl FeCl2 + H2 (3)
Ta thấy: Ngoài a gam Fe như thí nghiệm 1 cộng với b gam Mg mà chỉ giải phóng: < 0,024 (mol)
Chứng tỏ: Trong TN1: Fe dư, HCl hết
Ta có: nHCl (TN 1) = nHCl(TN 2) = 2nH = 2 . 0,02 = 0,04(mol)
TN1:
nFe(pư) = nFeCl= nHCl = . 0,04 = 0,02(mol)
=> mFe(dư) = 3,1 – 0,02.127 = 0,56 (gam)
mFe(pư) = 0,02 . 56 = 1,12(gam)
=> mFe = a = 0,56 + 1,12 = 1,68(gam)
*TN2:
Áp dụng ĐLBTKL:
a + b = 3,34 + 0,02.2 - 0,04.36,5 = 1,92 (g)
Mà a = 1,68g b = 1,92 - 1,68 = 0,24 (g)
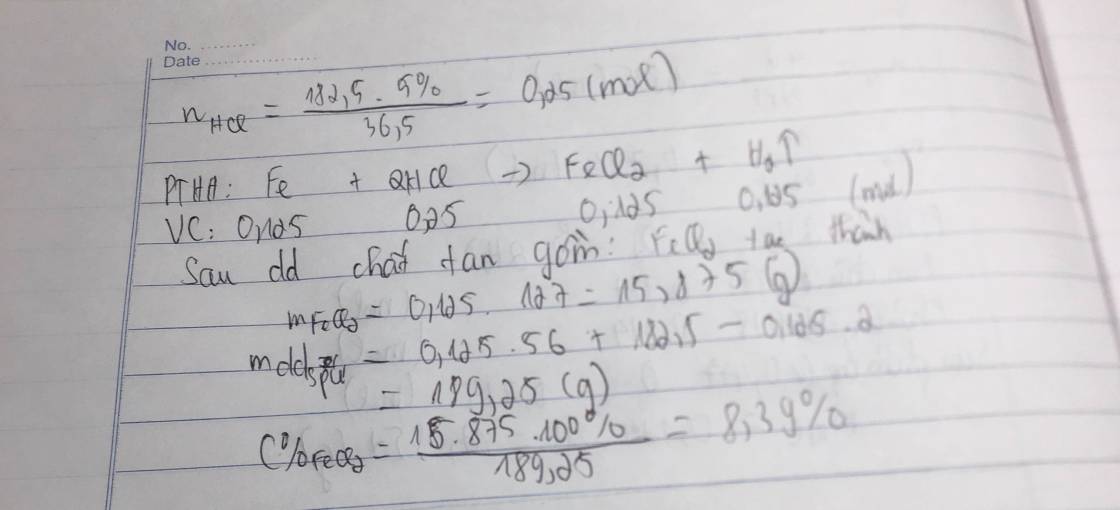
giải giúp mình với mấy bạn!!!
Pt: 2Al + 6HCl --> 2AlCl3 + 3H2
.....Fe + 2HCl --> FeCl2 + H2
......Mg + 2HCl --> MgCl2 + H2
mHCl = \(\dfrac{3,65\times100}{100}=3,65\left(g\right)\)
\(\Rightarrow n_{HCl}=\dfrac{3,65}{36,5}=0,1mol\)
Theo pt ta có: nH2 = \(\dfrac{1}{2}\) nHCl = \(\dfrac{1}{2}.0,1=0,05\) mol
=> VH2 = 0,05 . 22,4 = 1,12 (lít)
mH2 = 0,05 . 2 = 0,1 (g)
Áp dụng ĐLBTKL, ta có:
mhh + m dd HCl = mmuối khan + mH2
=> mmuối khan = mhh + mdd HCl - mH2 = 13,4 + 100 - 0,1 = 113,3 (g)