Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(CH_3COOH+C_2H_5OH⇌\left(H^+,t^o\right)CH_3COOC_2H_5+H_2O\\ n_{CH_3COOH}=\dfrac{12}{60}=0,2\left(mol\right);n_{C_2H_5OH}=\dfrac{13,8}{46}=0,3\left(mol\right)\\ Vì:\dfrac{0,3}{1}>\dfrac{0,2}{1}\Rightarrow C_2H_5OH.dư\\ n_{CH_3COOC_2H_5\left(LT\right)}=n_{CH_3COOH}=0,2\left(mol\right)\\ n_{CH_3COOC_2H_5\left(TT\right)}=\dfrac{11}{88}=0,125\left(mol\right)\\ \Rightarrow H=\dfrac{0,125}{0,2}.100\%=62,5\%\)
Ủa em ơi toán giải thì để người khác làm chứ em?

\({{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}}}}{\rm{ = }}\frac{{\rm{6}}}{{{\rm{60}}}}{\rm{ = 0,1 (mol); }}{{\rm{n}}_{{{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}}}}{\rm{ = }}\frac{{{\rm{5,2}}}}{{46}}{\rm{ }} \approx {\rm{ 0,113 (mol)}}\)
Phương trình hóa học:
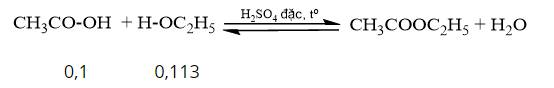
Ta có: \(\frac{{0,1}}{1} < \frac{{0,113}}{1}\) => acetic acid hết, ester tính theo acetic acid.
\(\begin{array}{l}{{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COO}}{{\rm{C}}_2}{{\rm{H}}_5}}}{\rm{ = }}{{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}}}}{\rm{ = 0,1 (mol) }}\\ \Rightarrow {{\rm{m}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COO}}{{\rm{C}}_2}{{\rm{H}}_5}}} = {\rm{0,1}} \times {\rm{88 = 8,8 (g)}}\\ \Rightarrow {\rm{H = }}\frac{{5,28}}{{8,8}} \times 100\% = 60\% \end{array}\)

2C2H5OH +2Na\(\rightarrow\)2C2H5ONa +H2
2C2H5OH +2Na--->2C2H5ONa +H2

8. Khi tăng nhiệt độ:
+ Phản ứng CaCO3(s) ⇌ CaO(s) + CO2(g) là phản ứng thu nhiệt nên khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều giảm nhiệt độ, tức chiều thuận.
+ Phản ứng 2SO2(g) + O2(g) ⇌ 2SO3(g) là phản ứng toả nhiệt, khi tăng nhiệt độ, phản ứng chuyển dịch theo chiều giảm nhiệt độ, tức chiều nghịch.
9.
a. Khi tăng nồng độ của C2H5OH, cân bằng chuyển dịch theo chiều thuận, giảm nồng độ của C2H5OH.
b. Khi giảm nồng độ của CH3COOC2H5, cân bằng chuyển dịch theo chiều thuận, tăng nồng độ CH3COOC2H5.

\(n_{hhspu}=\frac{25,5}{17}=1,5\left(mol\right)\)
\(PTHH:N_2+3H_2\underrightarrow{t^o,xt}2NH_3\)
(mol)_____1______3_______2
(mol)_____2/3____2_________4/3
Tỉ lệ: 3/1 > 6/3 => N2 dư
\(H=\frac{\frac{4}{3}}{1,5}.100=88,9\left(\%\right)\)
Ta có :
\(\text{ nNH3=1.5}\)
.................\(\text{ N2+2H2-->2NH3}\)
trươc..............3........6................
phản ứng........0.75.....1.5..........1.5
sau ...............2.25......4.5....1,5
\(\text{a. Số mol khí sau phản ứng=2.25+4.5+1.5=8.25}\)
b. Ta có \(\frac{3}{1}=\frac{6}{2}\)
=>Ta có thể tính hiệu suất theo N2 hoặc H2
\(\Rightarrow\text{H=0.75/3=25%}\)

Lấy dư carboxylic hoặc alcohol.
Thu hồi ester tạo thành khỏi khu vực phản ứng.

Câu 3: Gọi số mol NO là a . Có: n\(_{N_2}\) = n\(_{N_2O}\) = 2a => 5a = \(\dfrac{4,48}{22,4}\) = 0,2
=> a = 0,04 . Vậy: n\(HNO_3\) = a.4+2a.10+2a.12 = 1,92 (mol)
=> V\(_{HNO_3}\) = 1,92 (lít)
\(n_{CH_3COOH}=\dfrac{12}{60}=0,2\left(mol\right);n_{C_2H_5OH}=\dfrac{12}{46}=\dfrac{6}{23}\left(mol\right)\\ PTHH:CH_3COOH+C_2H_5OH⇌\left(H^+,t^o\right)CH_3COOC_2H_5+H_2O\\ Vì:0,2:1< \dfrac{6}{23}:1\Rightarrow Ethanol.dư\\ n_{este\left(LT\right)}=n_{acid}=0,2\left(mol\right)\\ n_{este\left(TT\right)}=\dfrac{8}{88}=\dfrac{1}{11}\left(mol\right)\\ \Rightarrow H=\dfrac{\dfrac{1}{11}}{0,2}.100\%\approx45,455\%\)