Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nAgX = nAg = 1,08 / 108 = 0,01 mol.
Phương trình hóa học của phản ứng:
Đặt X là kí hiệu, nguyên tử khối của halogen.
NaX + AgNO3 \(\rightarrow\) AgX + NaNO3.
2AgX \(\rightarrow\) 2Ag + X2.
nNaX = 0,01.
MNaX = 1,03 / 0,01 = 103.
X = 103 – 23 = 80 (Br).
Muối A có công thức phân tử là NaBr.
gọi công thức hóa học của muối natri halogenua là NaX NaX + AgNO3 =AgX +NaNO3 (1) 2 AgX= 2Ag + X2 (2) theo (1) va (2) ta có: \(\dfrac{1,03}{23+X}=0,01\) X=80 g/mol vậy A là NaBr

nAg=0,01 mol
NaX+AgN03------->NaN03+AgX,áp dụng bảo toàn nguyên tố Ag,nAg sau=nAg truoc
0,01--------------------------------0,01
MNaX=1,03/0,01=103------------------->X=80------->Br

nAg = 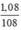 = 0,01 mol
= 0,01 mol
Phương trình hóa học của phản ứng:
Đặt X là kí hiệu, nguyên tử khối của halogen
NaX + AgNO3 → AgX↓ + NaNO3
0,01mol 0,01mol
2AgX → 2 Ag + X2
0,01mol 0,01mol
Theo pt: nNaX = nAgX = nAg = 0,1 mol
MNaX = 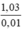 = 103 → X = 103 – 23 = 80 (Br)
= 103 → X = 103 – 23 = 80 (Br)
Muối A có công thức phân tử là NaBr

Câu 2 Bằng phương pháp hóa học hãy phân biệt các lọ mất nhãn đựng các loại hóa chất sau: NaNO3, HCl , NaCl , HNO3
NHÚM quỳ tím vào từng mẫu thử
có 2 mẫu làm quỳ tím chuyển đỏ HNO3,HCl (1)
có 2 mẫu ko làm chuyển màu là NaNO3,NaCl (2)
SAU ĐÓ CHO AgNO3 VÀO MẪU THỬ
MẪU THỬ (1) CÓ KẾT TỦA LÀ HCl
HCl+AgNO3--->HNO3+AgCl
mẫu còn lại là HNO3
MẪU THỬ 2 CÓ KẾT TỦA LÀ NaCl
NaCl+AgNO3-->AgCl+NaNO3
mẫu còn lại là NaNO3

nNaCl= 0,3 mol
AgNO3 + NaCl → AgCl↓ + NaNO3
0,3 mol → 0,3 mol
mkết tủa= mAgCl= 0,3x143,5=43,05 (g)
→ Đáp án đúng là: A

1.
a)
- Cho quỳ tím vào các dung dịch
Quỳ tím chuyển thành màu đỏ : HCl , HNO3 (nhóm 1 )
Quỳ tím chuyển thành màu xanh : KOH , Ba(OH)2 ( nhóm 2 )
Quỳ tím không xảy ra hiện tượng : NaCl và NaNO3 (nhóm 3 )
*Cho AgNO3 vào ( nhóm 1 ) ta được :
Kết tủa trắng : HCl
\(AgNO3+HCl\rightarrow AgCl\downarrow+HNO3\)
Không xảy ra hiện tượng : HNO3
*Cho AgNO3 vào (nhóm 3) ta được :
Kết tủa trắng : NaCl
\(NaCl+AgNO_3\rightarrow NaNO_3+AgCl\downarrow\)
Không xảy ra hiện tượng :NaNO3
*Cho H2SO4 vào ( nhóm 2) ta được :
Kết tủa trắng : Ba(OH)2
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4\downarrow+2H_2O\)
Không xảy ra hiện tượng : KOH
b)
- Cho quỳ tím vào các dung dịch
Quỳ tím chuyển thành màu đỏ : HCl , H2SO4 (nhóm 1)
Quỳ tìm chuyển thành màu xanh : NaOH
Không xảy ra hiện tượng :NaCl , NaBr ; NaI (nhóm 2)
*Cho AgNO3 vào (nhóm 1) ta được
Kết tủa trắng HCl
\(AgNO_3+HCl\rightarrow AgCl\downarrow+HNO_3\)
Không xảy ra hiện tượng H2SO4
Cho AgNO3 vào (nhóm 3) ta được
Kết tủa trắng là : NaCl
\(NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)
Chuyển thành màu vàng nhạt là :NaBr
\(AgNO3+NaBr\rightarrow AgBr\downarrow+NaNO_3\)
Chuyển thành màu vàng : NaI
\(AgNO_3+NaI\rightarrow AgI\downarrow+NaNO_3\)
2.
Cho hỗn hợp X vào HCl chỉ có Fe phản ứng:
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{H2}=\frac{0,448}{22,4}=0,02\left(mol\right)=n_{Fe}\)
Cho X tác dụng với Cl2
\(2Fe+3Cl_2\rightarrow2FeCl_3\)
\(Cu+Cl_2\rightarrow CuCl_2\)
\(\rightarrow n_{FeCl3}=n_{Fe}=0,02\left(mol\right)\)
\(\rightarrow m_{FeCl3}=0,02.\left(56+35,5.3\right)=3,25\left(g\right)\)
\(m_{CuCl2}=7,3-3,25=4,05\left(g\right)\)
\(\rightarrow n_{CuCl2}=\frac{4,05}{64+35,5.2}=0,03\left(mol\right)=n_{Cu}\)
\(\rightarrow m=m_{Fe}+m_{Cu}=0,02.56+0,03.64=3,04\left(g\right)\)
3.
Gọi số mol Al là x; Fe là y
\(\rightarrow27x+56y=8,3\left(g\right)\)
\(Al+3HCl\rightarrow AlCl_3+\frac{3}{2}H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(\rightarrow n_{H2}=1,5n_{Al}+n_{Fe}=1,5x+y=\frac{5,6}{22,4}=0,25\left(mol\right)\)
Giải được \(x=y=0,1\)
\(\rightarrow m_{Al}=0,1.27=2,7\left(g\right)\)
\(\rightarrow\%m_{Al}=\frac{2,7}{8,3}=32,5\%\rightarrow\%m_{Fe}=100\%-32,5\%=67,5\%\)
Ta có muôí gồm AlCl3 và FeCl2
\(\rightarrow m_{muoi}=0,1.\left(27+35,5.3\right)+0,1.\left(56+35,5.2\right)=20,05\left(g\right)\)
b) Ta có: nHCl phản ứng=2nH2=0,5 mol
\(n_{HCl_{tham.gia}}=0,5.120\%=0,6\left(mol\right)\)
\(\rightarrow V_{HCl}=\frac{0,6}{1}=0,6\left(l\right)\)

ta có \(CaX_2+2AgNO_3\rightarrow2AgX+Ca\left(NO_3\right)_2\)

1.
\(Br_2+SO_2+2H_2O\rightarrow H_2SO_4+2HBr\)
Phần 1
\(H_2SO_4+BaCl_2\rightarrow BaSO_4+2HCl\)
0,02_____________0,02___________
\(n_{BaSO_4}=\frac{4,66}{137+32+16.4}=0,02\left(mol\right)\)
Phần 2
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\)
\(Ba\left(OH\right)_2+2HBr\rightarrow BaBr_2+2H_2O\)
Ta thấy chia 2 phần bằng nhau mà kết tủa(BaSO4) phần 2 nhiều hơn phần 1
\(\rightarrow\) Phần 2 có SO2 tác dụng với Ba(OH)2
\(Ba\left(OH\right)_2+SO_2\rightarrow BaSO_3+H_2O\)
___________0,03_____0,03____________
\(m_{BaSO3}=1,17-4,66=6,5\left(l\right)\)
\(n_{BaSO3}=\frac{6,51}{137+32+16.3}=0,03\left(mol\right)\)
Tổng nSO2=2.(0,02+0,03)=0,1 (Vì chia làm 2 phần bằng nhau nên khi tính mol ban đầu phải nhân 2 nha bạn)
\(CM_{SO2}=\frac{0,1}{0,2}=0,5M\)
\(n_{Br2}=0,02.2=0,04\)
\(C\%_{Br2}=\frac{0,04.160}{32}=20\%\)
2.
a)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(BaCO_3+2HCl\rightarrow BaCl_2+CO_2+H_2O\)
\(MgCO_3+2HCl\rightarrow MgCl_2+CO_2+H_2O\)
\(BaCO_3\rightarrow BaO+CO_2\)
\(MgCO_3\rightarrow MgO+CO_2\)
b)
\(n_{hh_{khi}}=\frac{2,464}{22,4}=0,11\left(mol\right)\)
\(n_{CO2}=\frac{3,584}{22,4}=0,16\left(mol\right)\)
Gọi a là số mol Al b là số mol BaCO3 c là số mol MgCO3 trong 0,2 mol
Ta có:
\(\left\{{}\begin{matrix}a+b+c=0,2\\b+c=0,16\end{matrix}\right.\rightarrow a=0,04\left(mol\right)\)
\(\%n_{Al}=\frac{0,04}{0,2}.100\%=20\%\)
Gọi x là số mol Al y là nBaCO3 z là nMgCO3 trong 10,65 g X
Ta có
\(27x+197y=84x=10,65\)
\(1,5x+y+z=0,11\)
\(x=0,2.\left(x+y=z\right)\)
\(\rightarrow x=0,02;y=0,03;z=0,05\)
\(\%m_{Al}=\frac{0,02.27}{10,65}.100\%=5,07\%\)
\(\%m_{BaCO3}=\frac{0,03.197}{10,65}.100\%=55,49\%\)
\(\%m_{MgCO3}=39,44\%\)
3.
\(H_2+Cl_2\rightarrow2HCl\left(1\right)\)
______0,03___ 0,06
\(HCl+AgNO_3\rightarrow AgCl+HNO_3\left(2\right)\)
\(n_{AgCl}=\frac{0,17}{108+35,5}\)
\(n_{HCl\left(1\right)}=\frac{0,17}{108+35,5}.\frac{20}{5}=\frac{34}{7175}\)
\(n_{H2}=\frac{1}{22,4}\)
\(n_{Cl2}=\frac{0,672}{22,4}=0,03\left(mol\right)\)
\(H=\frac{34}{7175}/0,06.100\%=7,9\%\)
