Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) PTHH: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
a_____________________\(\dfrac{3}{2}\)a (mol)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
b____________________b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}27a+56b=11\\\dfrac{3}{2}a+b=\dfrac{8,96}{22,4}=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2\cdot27}{11}\cdot100\%\approx49,09\%\\\%m_{Fe}=50,91\%\end{matrix}\right.\)
b) PTHH: \(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\\n_{H_2}=\dfrac{3}{2}a+b=0,4\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) H2 còn dư, tính theo CuO
\(\Rightarrow n_{Cu}=0,2\left(mol\right)\) \(\Rightarrow m_{Cu}=0,2\cdot64=12,8\left(g\right)\)
Gọi n Al = a ( mol ) , n Fe = b ( mol )
Có: n H2 = 0,4 ( mol )
PTHH
2AL + 6HCL ===> 2ALCL3 + 3H2
a--------------------------------------a
Fe + 2HCl ====> FeCL2 + H2
b------------------------------------b
Ta có hpt:
\(\left\{{}\begin{matrix}27a+56b=11\\1,5a+b=0,4\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
=> m AL = 5,4 ( g ) ; m Fe = 5,6 ( g )
b) Có : n CuO = 0,2 ( mol )
PTHH:
CuO + H2 ====> Cu +H2O
0,2----0,2-----------0,2
theo pthh: n Cu = 0,2 ( mol ) => m Cu = 12,8 ( g )

n Fe = a(mol) ; n Mg = b(mol)
=> 56a + 24b = 8(1)
$Mg + 2HCl \to MgCl_2 + H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
n HCl = 2a + 2b = 14,6/36,5 =0,4(2)
Từ (1)(2) => a = b = 0,1
Vậy :
m Fe = 0,1.56 = 5,6(gam)
m Mg = 0,1.24 = 2,4(gam)
n H2 = a + b = 0,2(mol)
V = 0,2.22,4 = 4,48 lít
\(n_{Fe}=a\left(mol\right),n_{Mg}=b\left(mol\right)\)
\(n_{HCl}=\dfrac{14.6}{36.5}=0.4\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
mhh= 56a + 24b = 8 (g)
nHCl = 2a + 2b = 0.4 (mol)
=>a = 0.1
b = 0.1
mFe= 0.1 * 56 = 5.6 (g)
mMg = 2.4 (g)
nH2 = nHCl/2 = 0.4/2 = 0.2 (mol)
VH2 = 0.2*22.4 = 4.48 (l)

m dd sau pư = mFe + m dd HCl - mH2 thôi em nhé, Cu không phản ứng nên không cộng thêm vào.
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a) Theo Pt : \(n_{H2}=n_{Fe}=n_{FeCl2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(\%m_{Fe}=\dfrac{0,1.56}{10}.100\%=56\%\)
\(\%m_{Cu}=100\%-56\%=44\%\)
b) Theo Pt : \(n_{H2}=2n_{HCl}=2.0,1=0,2\left(mol\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{0,2.36,5}{7,3\%}.100\%=100\left(g\right)\)
c) \(m_{ddspu}=10+100-0,1.2=109,8\left(g\right)\)
\(C\%_{FeCl2}=\dfrac{0,1.127}{109,8}.100\%=11,57\%\)

a)
$Fe + 2HCl \to FeCl_2 + H_2$
$FeO + 2HCl \to FeCl_2 + H_2O$
b)
Theo PTHH : $n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$m_{Fe} = 0,15.56 = 8,4(gam)$
$m_{FeO} = 12 - 8,4 = 3,6(gam)$
$n_{FeO} =0,05(mol)$
Theo PTHH : $n_{HCl} = 2n_{Fe} + 2n_{FeO} = 0,4(mol)$
$V_{dd\ HCl} = \dfrac{0,4}{2} = 0,2(lít)$
c) $Fe + CuSO_4 \to FeSO_4 + Cu$
$n_{Cu} = n_{Fe} = 0,15(mol) \Rightarrow m_{chất\ rắn} = m_{FeO} + m_{Cu}$
$= 3,6 + 0,15.64 = 13,2(gam)$

\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 16,8 - 6,4 = 10,4(1)\\ Fe + 2HCl \to FeCl_2 + H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{H_2} = a + b = \dfrac{6,72}{22,4} = 0,3(2)\)
Từ (1)(2) suy ra: a = 0,1 ; b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,1.56}{16,8}.100\% = 33,33\%\\ \%m_{Mg} = \dfrac{0,2.24}{16,8}.100\% = 28,57\%\\ \%m_{Cu} = 100\% - 33,33\% - 28,57\% = 38,1\%\)

Đặt nAl=a(mol); nFe=b(mol) (a,b>0)
Ta có: nH2=8,96/22,4=0,4(mol)
PTHH: 2 Al + 6 HCl -> 2 AlCl3 + 3 H2
a_________3a____a____1,5a(mol)
Fe +2 HCl -> FeCl2 + H2
b__2b____b____b(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}27a+56b=16,7\\1,5a+b=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,25\end{matrix}\right.\)
=> mAl= 0,1.27=2,7(g) =>%mAl= (2,7/16,7).100=16,17%
=> CHỌN B

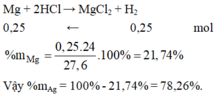
Câu 1 :
Pt : Mg + 2HCl → MgCl2 + H2\(|\)
1 2 1 1
a 2a
Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
b 2b
Gọi a là số mol của Mg
b là số mol của Fe
Theo đề ta có : mMg + mFe = 13,6 (g)
⇒ nMg . MMg + nFe . MFe = 13,6 g
24a + 56b = 13,6 g (1)
3000ml = 3l
Số mol của dung dịch axit clohidric
CMHCl = \(\dfrac{n}{V}\Rightarrow n=C_M.V=0,2.3=0,6\left(mol\right)\)
⇒ 2a + 2b = 0,6 (2)
Từ (1) , (2) , ta có hệ phương trình :
24a + 56b = 13,6
2a + 2b = 0,6
⇒ \(\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,2 . 56
= 11,2 (g)
Chúc bạn học tốt
Câu 2 :
Số mol của khí cacbonic ở dktc
nCO2 = \(\dfrac{V_{CO2}}{22,4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Pt : CO2 + Ca(OH)2 → CaCO3 + H2O\(|\)
1 1 1 1
0,15 0,15 Số mol của canxi cacbonat
nCaCO3 = \(\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
Khối lượng của canxi cacbonat
mCaCO3 = nCaCO3 . MCaCO3
= 0,15 .100
= 15 (g)
Chúc bạn học tốt