Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có Pt:
M2(SO4)3 + 6NaOH -> 3Na2SO4 + 2M(OH)3
Vậy chất kết tủa là M(OH)3
nM(OH)3=\(\dfrac{15,6}{2M+102}\) (mol)
\(n_{M2\left(SO4\right)3}=\dfrac{34,2}{2M+288}\left(mol\right)\)
\(\Leftrightarrow\dfrac{15,6}{2M+102}=\dfrac{34,2}{2M+288}\)
=> M=27
Vậy M là Al(Nhôm)

Gọi KL là R (KL có hoá trị n)
2R + 2nH2SO4-> R2(SO4)n + SO2 + 2nH2O
nSO2=3,36/22,4=0, 15(mol) lắp vào pt suy ra nR=0,3/n (mol).
MR=9,6.n/0,3
vì chưa biết hoá trị n nên ta lập bảng tìm hoá trị. R là KL nên có hoá trị 1, 2 hoặc 3. Cho n lần lượt bằng 1, 2,3 để tìm ra MR thoả mãn. Với n=2 thì MR=64(tm). KL là Cu
Bài 1 :Gọi KL là R (KL có hoá trị n)
2R + 2nH2SO4-> R2(SO4)n + SO2 + 2nH2O
nSO2=3,36/22,4=0, 15(mol) lắp vào pt suy ra nR=0,3/n (mol).
MR=9,6.n/0,3
vì chưa biết hoá trị n nên ta lập bảng tìm hoá trị. R là KL nên có hoá trị 1, 2 hoặc 3. Cho n lần lượt bằng 1, 2,3 để tìm ra MR thoả mãn. Với n=2 thì MR=64(tm). KL là Cu

a) Đặt số mol của MO, M(OH)2, MCO3 tương ứng là x, y, z.
Nếu tạo muối trung hòa ta có các phản ứng:
MO + H2SO4 →MSO4 + H2O (1)
M(OH)2 + H2SO4 →MSO4 + 2H2O (2)
MCO3 + H2SO4 →MSO4 + H2O + CO2 (3)
Nếu tạo muối axít ta có các phản ứng:
MO + 2H2SO4 →M(HSO4)2 + H2O (4)
M(OH)2 + 2H2SO4 →M(HSO4)2 + 2H2O (5)
MCO3 + 2H2SO4 →M(HSO4)2 + H2O + CO2 (6)
Ta có :
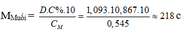
– TH1: Nếu muối là MSO4 M + 96 = 218 M = 122 (loại)
– TH2: Nếu là muối M(HSO4)2 M + 97.2 = 218 M = 24 (Mg)
Vậy xảy ra phản ứng (4, 5, 6) tạo muối Mg(HSO4)2
b) Theo (4, 5, 6) Số mol CO2 = 0,448/22,4 = 0,02 molz = 0,02 (I)
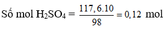
2x + 2y + 2z = 0,12 (II)
Đề bài: 40x + 58y + 84z = 3,64 (III)
Giải hệ (I, II, III): x = 0,02; y = 0,02; z = 0,02
%MgO = 40.0,02.100/3,64 = 21,98%
%Mg(OH)2 = 58.0,02.100/3,64 = 31,87%
%MgCO3 = 84.0,02.100/3,64 = 46,15%

\(n_{H_2}=\dfrac{3,7185}{24,79}=0,15\left(mol\right)\)
\(M+2HCl\rightarrow MCl_2+H_2\)
0,15<-0,3<---0,15<----0,15
a. \(M=\dfrac{8,4}{0,15}=56\left(g/mol\right)\)
Vậy M là kim loại Fe.
b. \(n_{NaOH}=0,5.1=0,5\left(mol\right)\)
\(HCl+NaOH\rightarrow NaCl+H_2O\)
0,2<-----0,2
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
0,15----->0,3
\(m_{dd.HCl}=\dfrac{\left(0,3+0,2\right).36,5.100\%}{10\%}=182,5\left(g\right)\)
\(m_{dd.A}=8,4+182,5-0,15.2=190,6\left(g\right)\)
\(C\%_{FeCl_2}=\dfrac{127.0,2.100\%}{190,6}=13,33\%\)
\(C\%_{HCl.dư}=\dfrac{0,3.36,5.100\%}{190,6}=5,75\%\)


BTKL: mD + mNaHCO3 = mCO2 + mE
mD + 179,88 = 44.0,2 + 492 => mD = 320,92
BTKL: mMg + mddHCl = mH2 + mD
=> 24 . 0,4 + mddHCl = 2 . 0,4 + 320,92 => mddHCl = 312,12
=> C%HCl = 11,69%

m(HCl)=31.025x20/100=6.205
a/vì số mol H2 luôn bằng 1/2 số mol HCl (theo định luật bảo toàn nguyên tố)
Mà nHCl=0.17(mol)
=>nH2=0.17/2=0.085(mol)
=>VH2=0.085x22.4=1.904(l)
Theo định luật bảo toàn khối lượng có:
m(muối) = m(kim loại) + m(axit) - m(H2)
=2 + 6.205 - 0.085x2
=8.035(g)

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)


1.
n H2SO4 = 0,1.0,2 = 0,02 (mol)
n NaOH = 0,08.0,25=0,02 (mol)
R + H2SO4 ----> RSO4 + H2
0,01___(0,02 - 0,01)
2NaOH + H2SO4 ----> Na2SO4 + 2H2O
0,02________0,01
M R = 0,24/0,01 = 24(g) => Magie_Mg
2.
CTTQ: R2(SO4)3
\(n_{\text{R2(SO4)3}}=\frac{34,2}{2R+288}\left(mol\right)\)
\(n_{\text{R(OH)3}}=\frac{15,6}{R+51}\left(mol\right)\)
R2(SO4)3 + 6NaOH ----> 3Na2SO4 + 2R(OH)3
\(\frac{34,2}{2R+288}\)_______________________________\(\frac{34,2}{R+144}\)
=> \(\frac{34,2}{R+144}=\frac{15,6}{R+51}\Leftrightarrow34,2R+1744,2=15,6R+2246,4\)
\(\Leftrightarrow18,6R=502,2\Leftrightarrow R=27\) => R là kim loại nhôm_Al