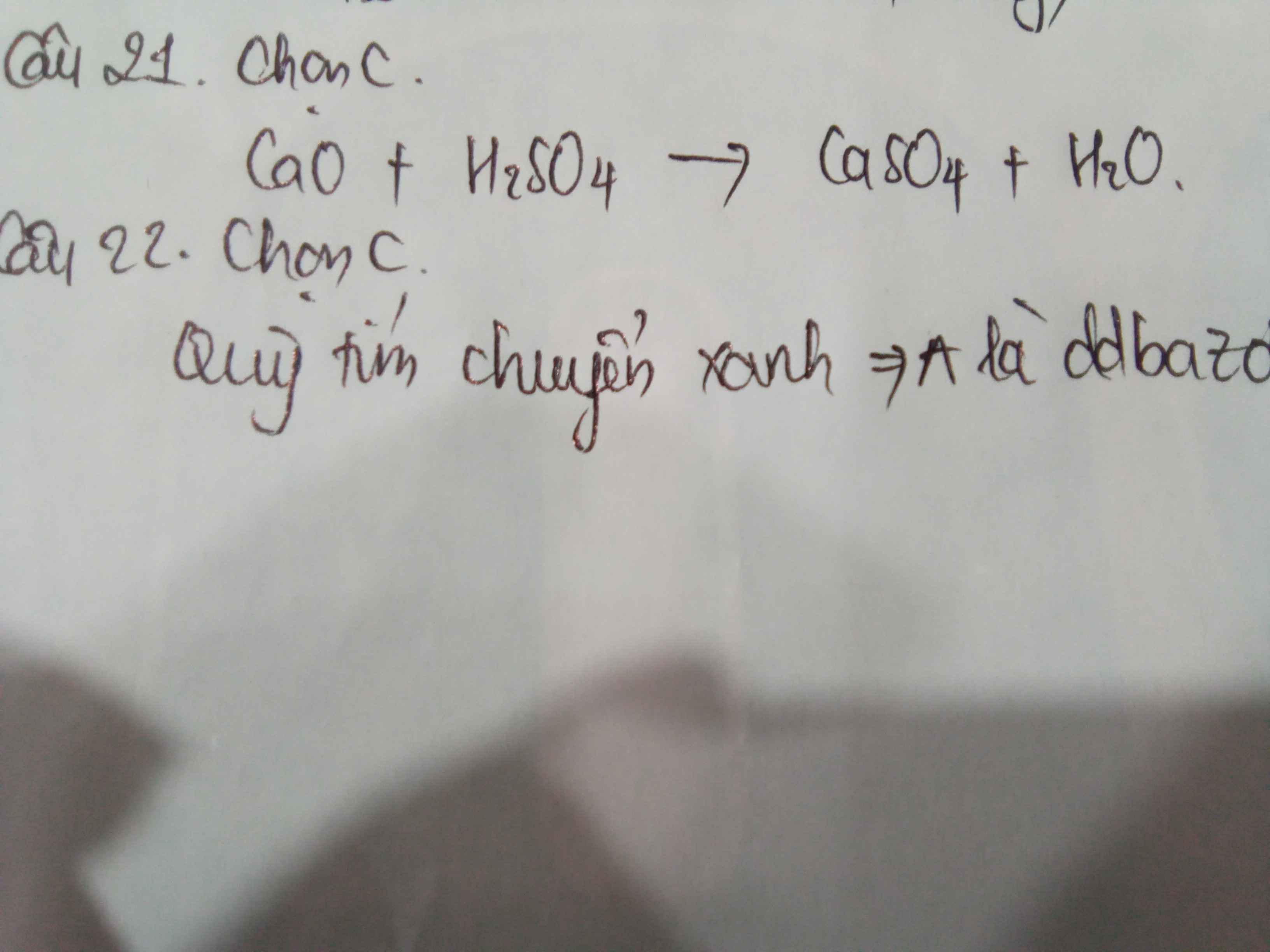Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1: câu D(Sinh ra H2 nhẹ hơn không khí)
Câu 2:A do thêm đến khi HCl dư,tức là dd có tính axit->quỳ tím đổi màu đỏ

ta có: dd spu làm đổi màu quỳ tím==> Có H2SO4 dư
==> NaOH hết, tính theo số mol NaOH.
gọi CMNaOH = a(M)==>nNaOH=0.06a(mol)
2NaOH+H2SO4-->Na2SO4+2H2O
0.06a----0.03a-------0.03a-------0.06a (mol)
H2SO4+2KOH-->K2SO4+2H2O
0.005<----0.01------0.005----0.01 (mol)
nH2SO4 đã phản ứng=0.05-0.005=0.03a==>a=1.5(M)

a) \(CO_2,HCl,Al_2O_3\)
PTHH đặc biệt: \(Al_2O_3+2NaOH\rightarrow2NaAlO_2+H_2O\)
b) \(Fe,Ba\left(OH\right)_2,Na_2CO_3.Ba\left(NO_3\right)_2\)
PTHH đặc biệt: \(H_2O+2Na_2CO_3+2CuSO_4\rightarrow2Na_2SO_4+CO_2+\left[CuOH\right]_2CO_3\)
c) \(Fe,Ba\left(OH\right)_2,Na_2CO_3,Ba\left(NO_3\right)_2,Fe_2O_3,Al_2O_3\)
d) \(H_2O,CO_2,HCl,Al_2O_3\)
PTHH đặc biệt: \(Al_2O_3+CaO\rightarrow Ca\left(AlO_2\right)_2\)

Chỉ ra các hợp chất hữu cơ
A. CH4; C2H2; CO
B. C6H6; CH4; CH4O
C. C2H2; C2H6O
D. CH4; C2H6; CO2
Cặp chất không phản ứng với nhau là
A. Dung dịch Cu và dung dịch H2SO4 loãng
B. Dung dịch CaCl2 và dung dịch Na2CO3
C. Fe và dung dịch CuSO4
D. Dung dịch NaOH và HCl

a. [ H+] trong A: 2.2.10-4 + 6.10-4 = 10-3 mol pH = 3
[OH-] trong B: 3.10-4 + 2.3,5.10-4 = 10-3 mol pOH = 3 ® pH =11
b. Trong 300ml dung dịch A có số mol H+ = 0,3.10-3 mol Trong 200 ml dung dịch B có số mol OH- = 0,2.10-3 mol
Dung dịch C có: V = 0,5 lít; số mol H+ = 0,3.10-3 - 0,2.10-3 = 10-4 mol
Dạng 2: Pha trộn dung dịch
Phương pháp giải
+ Sử dụng phương pháp đường chéo, ghi nhớ: Nước có C% hoặc CM =0.
+ Xác định số mol chất, pH ® [H+]® mol H+ hoặc mol OH-.
+ Việc thêm, cô cạn nước làm thay đổi nồng độ mol/l và không làm thay đổi số mol chất
® tính toán theo số mol chất.