Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số mol hỗn hợp khí X:
n(X) = n(Cl2) + n(O2) = 11,2/22,4 = 0,5mol [1]
Theo ĐL bảo toàn khối lượng:
m(X) + m(Y) = m(Z) ⇒ m(X) = m(Cl2) + m(O2) = m(Z) - m(Y) = 42,34 - 16,98
⇒ 71.n(Cl2) + 32.n(O2) = 25,36 [2]
Từ [1], [2] ⇒ n(Cl2) = 0,24mol và n(O2) = 0,26mol
Phần trăm thể tích của oxi trong X:
%O2 = V(O2)/V(X) .100% = 0,26.22,4/11,2 .100% = 52%

a)Gọi x,y lần lượt là số mol của Al, Fe trong hỗn hợp ban đầu (x,y>0)
Sau phản ứng hỗn hợp muối khan gồm: \(\left\{{}\begin{matrix}AlCl_3:x\left(mol\right)\\FeCl_2:y\left(mol\right)\end{matrix}\right.\)
Ta có hệ phương trình: \(\left\{{}\begin{matrix}27x+56y=13,9\\133,5x+127y=38\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x\approx0,0896\\y\approx0,205\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,0896\cdot27\cdot100\%}{13,9}\approx17,4\%\\\%m_{Fe}=\dfrac{0,205\cdot56\cdot100\%}{13,9}\approx82,6\%\end{matrix}\right.\)
Theo Bảo toàn nguyên tố Cl, H ta có:\(n_{H_2}=\dfrac{n_{HCl}}{2}=\dfrac{3n_{AlCl_3}+2n_{FeCl_2}}{2}\\ =\dfrac{3\cdot0,0896+2\cdot0,205}{2}=0,3394mol\\ \Rightarrow V_{H_2}=0,3394\cdot22,4\approx7,6l\)

Gọi : \(\left\{{}\begin{matrix}n_{Al_2O_3}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\end{matrix}\right.\)⇒ 102a + 65b = 2,505(1)
\(Al_2O_3 + 6HCl \to 2AlCl_3 + 3H_2O\\ Zn + 2HCl \to ZnCl_2 + H_2\)
Muối gồm : \(\left\{{}\begin{matrix}AlCl_3:2a\left(mol\right)\\ZnCl_2:b\left(mol\right)\end{matrix}\right.\)⇒ 133,5.2a + 136b = 6,045(2)
Từ (1)(2) suy ra : a = 0,015 ; b = 0,015
Vậy :
\(\%m_{Al_2O_3} = \dfrac{0,015.102}{2,505}.100\% = 61,08\%\\ \%m_{Zn} = 100\% - 61,08\% = 38,92\%\)
Theo PTHH : \(n_{HCl} = 6a + 2b = 0,12(mol)\\ \Rightarrow C\%_{HCl} = \dfrac{0,12.36,5}{200}.100\% = 2,19\%\)

Câu 1 :
\(n_{H2}=\dfrac{5,04}{22,4}=0,225\left(mol\right)\)
Pt : \(2Al+6HCl\rightarrow2AlCl_3+3H_2|\)
2 6 2 3
a 0,15 1,5a
\(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
b 0,3 1b
a) Gọi a là số mol của Al
b là số mol của Zn
\(m_{Al}+m_{Zn}=11,1\left(g\right)\)
⇒ \(n_{Al}.M_{Al}+n_{Zn}.M_{Zn}=11,1g\)
⇒ 27a + 65b = 11,1g(1)
Theo phương trình : 1,5a + 1b = 0,225(2)
Từ(1),(2), ta có hệ phương trình :
27a + 65b = 11,1g
1,5a + 1b = 0,225
⇒ \(\left\{{}\begin{matrix}a=0,05\\b=0,15\end{matrix}\right.\)
\(m_{Al}=0,05.27=1,35\left(g\right)\)
\(m_{Zn}=0,15.65=9,75\left(g\right)\)
0/0Al = \(\dfrac{1,35.100}{11,1}=12,16\)0/0
0/0Zn = \(\dfrac{9,75.100}{11,1}=87,84\)0/0
b) \(n_{HCl\left(tổng\right)}=0,15+0,3=0,45\left(mol\right)\)
\(V_{ddHCl}=\dfrac{0,45}{1}=0,45\left(l\right)\)
Chúc bạn học tốt
Câu 2 :
\(n_{H2}=\dfrac{1,456}{22,4}=0,065\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
a 0,1 1a
\(2Al+6HCl\rightarrow2AlCl_3+3H_2|\)
2 6 2 3
b 0,03 1,5b
a) Gọi a là số mol của Fe
b là số mol của Al
\(m_{Fe}+m_{Al}=3,07\left(g\right)\)
⇒ \(n_{Fe}.M_{Fe}+n_{Al}.M_{Al}=3,07g\)
⇒ 56a + 27b = 3,07g(1)
Theo phương trình : 1a + 1,5b = 0,065(2)
Từ(1),(2),ta có hệ phương trình :
56a + 27b = 3,07g
1a + 1,5b = 0,065
⇒ \(\left\{{}\begin{matrix}a=0,05\\b=0,01\end{matrix}\right.\)
\(m_{Fe}=0,05.56=2,8\left(g\right)\)
\(m_{Al}=0,01.27=0,27\left(g\right)\)
0/0Fe = \(\dfrac{2,8.100}{3,07}=91,21\)0/0
0/0Al = \(\dfrac{0,27.100}{3,07}=8,79\)0/0
b) \(n_{HCl\left(tổng\right)}=0,1+0,03=0,13\left(mol\right)\)
\(m_{HCl}=0,13.36,5=4,745\left(g\right)\)
\(m_{ddHCl}=\dfrac{4,745.100}{10}=47.45\left(g\right)\)
Chúc bạn học tốt

a, PT: \(Fe+S\underrightarrow{t^o}FeS\)
Ta có: \(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
\(n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,1}{1}\), ta được Fe dư.
Chất rắn A gồm Fe dư và FeS.
Theo PT: \(n_{Fe\left(pư\right)}=n_{FeS}=n_S=0,1\left(mol\right)\)
\(\Rightarrow n_{Fe\left(dư\right)}=0,2\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2}=n_{Fe\left(dư\right)}=0,2\left(mol\right)\\n_{H_2S}=n_{FeS}=0,1\left(mol\right)\end{matrix}\right.\)
Ở cùng điều kiện nhiệt độ và áp suất, %V cũng là % số mol.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{0,2}{0,2+0,1}.100\%\approx66,67\%\\\%V_{H_2S}\approx33,33\%\end{matrix}\right.\)
b, Ta có: \(\Sigma n_{HCl\left(dadung\right)}=2n_{Fe}+2n_{FeS}=0,6\left(mol\right)\) (1)
PT: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Ta có: \(n_{NaOH}=0,1.2=0,2\left(mol\right)\)
\(\Rightarrow n_{HCl\left(dư\right)}=n_{NaOH}=0,2\left(mol\right)\) (2)
Từ (1) và (2) \(\Rightarrow\Sigma n_{HCl}=0,8\left(mol\right)\)
\(\Rightarrow C_{M_{ddHCl}}=\dfrac{0,8}{0,5}=1,6\left(M\right)\)
Bạn tham khảo nhé!
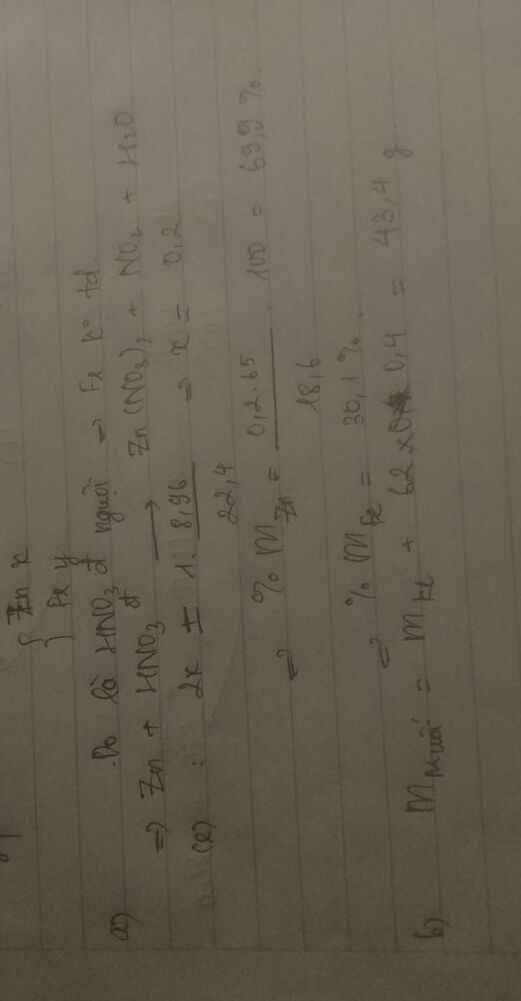


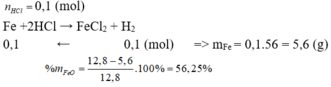
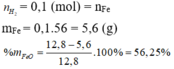
3/
a/
CuO+2HCl→CuCl\(_2\)+H\(_2\)O
0,05 0,1 0,05
2Al+6HCl→2AlCl\(_3\)+3H\(_2\)
0,1 0,3 0,1 0,15(mol)
n\(_{H_2}\)=\(\dfrac{3,36}{22,4}\)=0,15(mol)
m\(_{Al}\)=0,1.27=2,7(g)
⇔%m\(_{Al}\)=\(\dfrac{2,7}{6,7}.100\%\)≃40,3%
→%m\(_{CuO}\)=100%-40,3%=59,7%
b/
m\(_{CuO}\)=6,7-2,7=4(g)
n\(_{CuO}\)=\(\dfrac{4}{80}\)=0,05(mol)
m\(_{HCl}\)=(0,1+0,3).36,5=14,6(g)
m\(_{dd}\)=\(\dfrac{14,6.100\%}{14,6\%}\)=100(g)
m\(_{CuCl_2}\)=0,05.135=6,75(g)
C%\(_{CuCl_2}\)=\(\dfrac{6,75}{100}.100\%\)=6,75%
m\(_{AlCl_3}\)=0,1.133,5=13,35(g)
C%\(_{AlCl_3}\)=\(\dfrac{13,35}{100}.100\%\)=13,35%
1/
2Al+6HCl→2AlCl\(_3\)+3H\(_2\)
a a 3/2a (mol)
Fe+2HCl→FeCl\(_2\)+H\(_2\)
b b b (mol)
n\(_{H_2}\)=\(\dfrac{8,96}{22,4}\)=0,4(mol)
a/
gọi số mol của Al là a;số mol của Fe là b,ta có hệ phương trình:
27a+56b=11
\(\dfrac{3}{2}\)a+b=0,4
⇔ a=0,2(mol)
b=0,1(mol)
→m\(_{Al}\)=27.0,2=5,4(g)
⇔%m\(_{Al}\)=\(\dfrac{5,4}{11}.100\%\)≃49,1%
→%m\(_{Fe}\)=100%-49,1%=50,9%
b/
m\(_{AlCl_3}\)=0,2.133,5=26,7(g)
m\(_{FeCl_2}\)=0,1.127=12,7(g)
→m\(_{muối}\)=26,7+12,7=39,4(g)