Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phải dùng 4,2 g Fe
Cần 6g sắt (III) oxit tác dụng với H2 dư

nH2=\(\dfrac{1,68}{22,4}\)=0,075mol
Fe + H2SO4 -> FESO4 + H2
n ban đầu: 0,2mol
n pứ: 0,075mol 0,075mol 0,075mol
Vì \(\dfrac{0,2}{1}\)>\(\dfrac{0,075}{1}\) nên H2SO4 dư
a) mFe pứ= 0,075.56=4,2g
b) Fe2O3 + 3H2 -> 2Fe + 3H2O
n pứ: 0,0375mol 0,075mol
mFe2O3 pứ=0,0375.160=6g

Fe+H2SO4-->FeSO4+H2
theo PTHH=> nH2SO4=nFE=0,2mol
=>mFe=0,2.56=11,2gam
c) Fe2O3 + 3H2---> 2Fe +3 H2O
nFe=0,2 mol.Theo PTHH=> nFe2O3=0,1mol
=> KL Fe2O3 cần dùng là 0,1.160=16gam
Ta có: nH2SO4=0,2 (mol) (theo đầu bài)
PT:
Fe + H2SO4 -> FeSO4 + H2
1...........1.............1............1 (mol)
0,2 <- 0,2 -> 0,2 -> 0,2 (mol)
b) mFe=n.M=0,2.56=11,2(gam)
c) PT:
Fe2O3 + 3H2 -t0-> 2Fe + 3H2O
1................3..............2..............3 (mol)
0,1 <- 0,3 <- 0,2 -> 0,3 (mol)
=> mFe2O3=n.M=0,1.160=16(g)
Vậy khối lượng Fe2O3 cần dùng là 16 gam

\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,3 0,3
a)\(m_{Fe}=0,3\cdot56=16,8g\)
b)\(Fe_2O_3+3H_2\rightarrow3Fe+3H_2O\)
0,1 0,3 0,3
\(m_{Fe_2O_3}=0,1\cdot160=16g\)
a)nH2 =6,72:22,4=0,3(mol)
PTHH Fe+H2SO4--->FeSO4+H2
theo pt , nFe = nH2 = 0,3 (mol)
=> mFe =n.M=0,3.56=16,8(g)
b) Ta có nH2=nFe=0,3(MOL)
Pthh: Fe2O3 + 3H2 ---> 2Fe + 3H2O
theo pt , nFe2O3=1/3 nH2=0,1(mol)
=> mFe2O3= n.M=0,1.(56.2+16.3)=16(g)
Vậy để có lượng sắt tham gia phản ứng trên phải có 16g Fe2O3 để tác dụng với H2

Câu 1:
a, Thí nghiệm 1:
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
Thí nghiệm 2:
\(3H_2+Fe_2O_3\underrightarrow{^{t^o}}2Fe+3H_2O\)
b, Ta có:
\(n_{Mg}=\frac{13,44}{24}=0,56\left(mol\right)\)
\(\Rightarrow n_{H2}=n_{MgSO4}=n_{Mg}=0,56\left(mol\right)\)
\(\Rightarrow V_{H2}=0,56.22,4=12,544\left(l\right)\)
\(\Rightarrow m_{MgSO4}=0,56.120=67,2\left(g\right)\)
c,\(n_{Fe2O3}=\frac{1}{3}n_{H2}=\frac{1}{3}.0,56=\frac{14}{75}\left(mol\right)\)
\(\Rightarrow m_{Fe2O3}=\frac{14}{75}.160=\frac{448}{15}\left(g\right)\)
Câu 2:
d,
\(Zn+2HCl\rightarrow ZnCl_2+H_2\left(1\right)\)
\(Fe_3O_4+4H_2\underrightarrow{^{t^o}}3Fe+4H_2O\left(2\right)\)
e, Ta có:
\(n_{H2}=\frac{5,376}{22,4}=0,24\left(mol\right)\)
Theo PTHH1:
\(n_{HCl}=2n_{H2}=0,48\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,4.36,5=17,52\left(g\right)\)
\(n_{ZnCl2}=n_{H2}=0,24\left(mol\right)\)
\(\Rightarrow m_{ZnCl2}=0,24.136=32,64\left(g\right)\)
f, Theo PTHH2:
\(n_{Fe3O4}=\frac{1}{4}n_{H2}=0,06\left(mol\right)\)
\(\Rightarrow m_{Fe3O4}=0,06.232=13,92\left(g\right)\)

a, \(PTHH:CuO+H_2\underrightarrow{^{t^o}}Cu+H_2O\)
Ta có:
\(n_{H2}=\frac{6,72}{22,4}=0,3\left(mol\right)\)
\(\Rightarrow n_{Cu}=n_{H2}=0,3\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,3.64=19,2\left(g\right)\)
b,
i .\(PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\)
ii. \(n_{FeCl2}=116,2\left(g\right)\) ( Đề cho)
iii: \(n_{FeCl2}=\frac{116,2}{127}=0,9\left(mol\right)\)
\(\Rightarrow n_{HCl}=2n_{FeCl2}=1,8\left(mol\right)\)
\(\Rightarrow m_{HCl}=1,8.36,5=65,7\left(g\right)\)
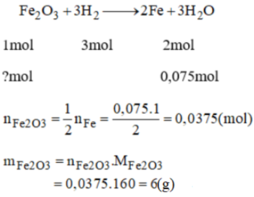
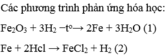
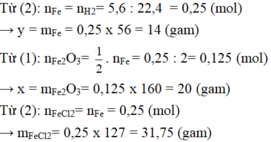
\(a.n_{H_2SO_4}=0,2\left(mol\right)\\ n_{H_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\\ PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ Vì:\dfrac{0,2}{1}>\dfrac{0,075}{1}\\ \Rightarrow H_2SO_4dư\\ b.n_{Fe}=n_{H_2}=0,075\left(mol\right)\\ m_{Fe}=56.0,075=4,2\left(g\right)\\ c.PTHH:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\\ 0,025........0,075.......0,05.......0,075\left(mol\right)\\ m_{Fe_2O_3}=0,025.160=4\left(g\right)\)