Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi công thức tổng quát là $XH_4$
\(\%H=25\%\\ \Rightarrow \dfrac{4}{X+4}.100\%=25\%\\ \Rightarrow X=12\\ Tên:\ Cacbon\\ CTHH:\ CH_4\)

CTTQ: XaOb
O có hóa trị II => a = 2
=> b = 7-2=5
=> CTTQ: X2O5
Theo đề bài ta có:
2X16.52X16.5 =11,2911,29
=> X = 31
=> X: P (photpho)
=> CTHH: P2O5

ta có a=2 do oxi có hóa trị II =>b=5
Vậy X có CTCT : X2O5
Ta có: 2MX/5MO=1/1.26 <=>MX=5x16/(2x1.29)=31
=>X là P
=> Ct oxit là P2O5

1.\(\dfrac{m_{Al}}{m_O}=\dfrac{9}{8}\)
\(Al_xO_y\)
\(x:y=\dfrac{9}{27}:\dfrac{8}{16}=\dfrac{1}{3}:\dfrac{1}{2}=2:3\)
Vậy CTHH là \(Al_2O_3\)
2.\(\rightarrow\%S=100-60=40\%\)
\(S_xO_y\)
\(x:y=\dfrac{40}{32}:\dfrac{60}{16}=1,25:3,75=1:3\)
Vậy CTHH là \(SO_3\)
3.
a.b.
\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(n_{H_2SO_4}=2.0,2=0,4mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,2 < 0,4 ( mol )
0,2 0,2 0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48l\)
Chất dư là H2SO4
\(m_{H_2SO_4\left(dư\right)}=\left(0,4-0,2\right).98=19,6g\)
c.Nồng độ gì bạn nhỉ?

CTPT: FexOy
Có: \(\dfrac{m_{Fe}}{m_O}=\dfrac{56x}{16y}=\dfrac{7}{3}\)
=> \(\dfrac{x}{y}=\dfrac{2}{3}\)
=> CTPT: Fe2O3
Gọi CTHH là \(Fe_xO_y\)
\(x:y=\dfrac{m_{Fe}}{56}:\dfrac{m_O}{16}=\dfrac{7}{56}:\dfrac{3}{16}=\dfrac{1}{8}:\dfrac{3}{16}=1:\dfrac{3}{2}=2:3\)
\(\Rightarrow\left\{{}\begin{matrix}x=2\\y=3\end{matrix}\right.\Rightarrow Fe_2O_3\)

Gọi công thức hóa học của oxit sắt là: F e x O y :
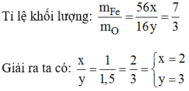
Công thức hóa học: F e 2 O 3 .

Bài 1 :
Gọi CTHH của X là X2O
\(\%_O=100\%-25,8\%=74,2\%\)
Tỉ lệ :\(\frac{74,2}{2X}=\frac{25,8}{16}\)
\(\Leftrightarrow74,2.16=2X.25,8\)
\(\Leftrightarrow1187,2=2X.25,8\Leftrightarrow1187,2=51,6X\)
\(\Leftrightarrow X=\frac{1187,2}{51,6}=23\)
Nguyên tố cần tìm là Na
Bài 2 :
\(M_{Fe}:M_O=\frac{56x}{16y}=\frac{21}{18}\)
\(\Leftrightarrow\frac{448x}{336y}=\frac{x}{y}=\frac{3}{4}\)
\(\Leftrightarrow x=3;y=4\)
Vậy CT của oxit sắt: Fe3O4
\(PTK_{Fe3O4}=3.56+4.16=232\left(đvC\right)\)
Bài 3 :
Gọi công thức hoá học của chất X là: CxOy
Theo đề bài ra ta có:
\(M_C:M_O=12x+16y=3:8\)
\(\Leftrightarrow96x=48y\)
\(\Rightarrow x:y=1:2\) ( Chọn x = 1 , y = 2 )
Vậy công thức hoá học của chất khí X là: CO2
Bài 4 :
Ta có
\(M_{Al2O3}=27.2+3.16=102\left(\frac{g}{mol}\right)\)
\(\%m_{Al}=\frac{2.27}{102}.100\%=52,94\%\)
K/lượng của Al trong 30,6 g Al2O3 là:
\(30,6.52,94\%=16,2\left(g\right)\)
\(\%m_O=\frac{16.3}{102}.100\%=47,06\%\)
K/lượng của O trong 30,6 g Al2O3 là:
\(30,6.47,06\%=14,4\left(g\right)\)
Bài 1
Bài 2
Ta có
\(m_{Fe}:m_O=21:8\)
\(\Rightarrow n_{Fe}:n_O=\frac{21}{56}:\frac{8}{16}=0,375:0,5=3:4\)
CTHH;Fe3O4
PTK: 56.3+16.4=232 đvc
Bài 3
\(m_C:m_O=3:8\)
\(\Rightarrow n_C:n_O=\frac{3}{12}:\frac{8}{16}=0,25:0,5=1:2\)
CTHH:CO2
PTK:12+16.2=44đvc
Bài 4
\(n_{Al2O3}=\frac{30,6}{102}=0,3\left(mol\right)\)
\(n_{Al}=2n_{Al2O3}=0,6\left(mol\right)\)
\(m_{Al}=0,6.27=16,2\left(g\right)\)
\(n_{O2}=3n_{Al2O3}=0,9\left(mol\right)\)
\(m_{O2}=0,9.16=14,4\left(g\right)\)