Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Sau phản ứng pH = 12 ⇒ O H - dư
[ O H − ] d u = 10 − 2 M
n O H − d u = 0 , 01.0 , 2 = 0 , 002 m o l
Phản ứng:
H + + O H − → H 2 O V ậ y n O H − b đ = 0 , 01 + 0 , 002 = 0 , 012 m o l O H − b đ = 0 , 012 / 0 , 1 = 0 , 12 M
C M ( N a O H ) = 0 , 02 M .

`100mL=0,1L`
`n_{H^+}=0,1.0,05.2+0,1.0,1=0,02(mol)`
`n_{SO_4^{2-}}=0,1.0,05=0,005(mol)`
`n_{OH^-}=0,1.0,2+0,1.0,1.2=0,04(mol)`
`n_{Ba^{2+}}=0,1.0,1=0,01(mol)`
`Ba^{2+}+SO_4^{2-}->BaSO_4`
Do `0,01>0,005->` Tính theo `SO_4^{2-}`
`n_{BaSO_4}=n_{SO_4^{2-}}=0,005(mol)`
`->m_↓=0,005.233=1,165(g)`
`H^{+}+OH^{-}->H_2O`
Do `0,02<0,04->OH^-` dư
`n_{OH^{-}\ pu}=n_{H^+}=0,02(mol)`
`->n_{OH^{-}\ du}=0,04-0,02=0,02(mol)`
Trong X: `[OH^-]={0,02}/{0,1+0,1}=0,1M`
`->pH=14-pOH=14+lg[OH^-]=13`

Chọn D
Trộn 3 dung dịch với thể tích bằng nhau thu được 150 ml dung dịch X → mỗi dung dịch lấy 50ml.
→ n H + = 0,05.0,2 + 0,05.2.0,1 + 0,05.0,08 = 0,024 mol.
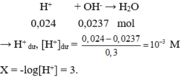

a) trong 100 ml dung dịch HCl và H2SO4
CM[H+]=[Cl-]=0,02 M
[SO4 2-]=0,01M
[H+] =2.0,01=0,02 M
trong 100ml dung dịch KOH và Ba(OH)2
[K+]=[OH-]=0,01M
[Ba2+]=0,01M
[OH-]=0,02M
b)n(H+)=0,02+0,02=0,04mol
n(OH-)=0,01+0,02=0,03mol
khi trộn : H+ + OH- =>H2O
0,03<--0,03
=> nH+ dư=0,01mol
=> [H+]=0,05M
=> pH=-lg(0,05)=1,3
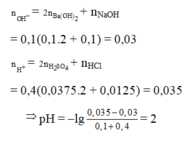

dung dịch Z có pH=13-> dung dịch Z chứa OH có nồng độ là 0,1M
ta có nH+=0,5anH+=0,5a mol ,nOHnOH = 0,5b mol
H++OH→H2OH++OH→H2O
dung dịch Z chứa OH →nOHdư=0,5b−0,5a→nOHdư=0,5b−0,5a mol
→[OH−]=0,5b−0,5aa+b=0,1M→0,4b−0,6a=0(1)→[OH−]=0,5b−0,5aa+b=0,1M→0,4b−0,6a=0(1)
theo đề bài -> a + b = 1 (2)
giải hệ chứa (1) và (2) -> a = 0,4 và b = 0,6
A = 0,4 b = 0,6