Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a. \(n_{Fe_3O_4}=\dfrac{6,96}{232}=0,03\left(mol\right)\)
PTHH : 3Fe + 2O2 -to-> Fe3O4
0,09 0,06 0,03
\(m_{Fe}=0,09.56=5,04\left(g\right)\)
\(V_{O_2}=0,06.22,4=1,344\left(l\right)\)
b. PTHH : 2KCl + 3O2 -> 2KClO3
0,06 0,04
\(m_{KClO_3}=0,04.122,5=4,9\left(g\right)\)

a.b.
\(n_{Fe}=\dfrac{16,8}{56}=0,3mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,3 0,2 0,1 ( mol )
\(m_{Fe_3O_4}=0,1.232=23,2g\)
\(V_{O_2}=0,2.22,4=4,48l\)
\(V_{kk}=4,48.5=22,4l\)
c.
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,4 0,2 ( mol )
\(m_{KMnO_4}=\dfrac{0,4.158}{\left(100-20\right)\%}=79g\)
a/ Số mol Fe là : nFe = 16,8: 56 = 0,3 mol
PTPƯ:
3Fe + 2O2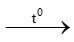 Fe3O4 (1)
Fe3O4 (1)
0,3 mol → 0,2mol → 0,1 mol
Từ (1) ta có số mol Fe3O4 = 0,1mol
→ m Fe3O4 = n.M = 0,1.232 = 23,2gam
b/ Từ (1) ta có số mol O2 đã dùng nO2 = 0,2 mol
Thể tích khí oxi đã dùng ở đktc: VO2 = n.22,4 = 0,2.22,4 = 4,48 lít
Thể tích không khí đã dùng: Vkk = 5. VO2= 5.4,48 = 22,4 lít.
c/ PTPƯ
2 KMnO4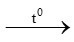 K2MnO4 + MnO2 + O2 (2)
K2MnO4 + MnO2 + O2 (2)
0,4444mol ← 0,222mol
Vì lượng Oxi thu được hao hụt 10% nên số mol O2 cần có là:
nO2 = 0,2mol.100/90 = 0.222 mol
Từ (2) ta có số mol KMnO4 = 0,444mol
Khối lượng KMnO4 bị nhiệt phân
mKMnO4 = n.M = 0,444.158 = 70.152 gam

a) \(n_{Fe_3O_4}=\dfrac{23,2}{232}=0,1\left(mol\right)\)
PT: 3Fe + 2O2 \(\underrightarrow{t^o}\) Fe3O4
mol 0,3 0,2 ← 0,1
mFe = 0,1.56 = 5,6 (g)
b) Vì tỉ lệ V = tỉ lệ n nên:
\(n_{O_2}=0,2.\left(100\%-10\%\right)=0,18\left(mol\right)\)
PT: 2KClO3 \(\underrightarrow{t^o}\) 2KCl + 3O2
mol 0,12 0,12 ← 0,18
\(m_{KClO_3}=0,12.122,5=14,7\left(g\right)\)

\(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\\ pthh:3Fe+2O_2\underrightarrow{t^o}Fe_3O_{\text{4}}\)
0,15 0,1 0,05
\(m_{Fe_2O_4}=0,05.232=11,6\left(g\right)\\
V_{O_2}=0,1.11,4=2,24\left(l\right)\\
pthh:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
0,2 0,1
\(m_{KMnO_4}=0,2.158=31,6\left(g\right)\)
\(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\\ pthh:3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,15 0,1 0,05
\(m_{Fe_3O_{\text{ 4}}}=0,05.232=11,6\left(g\right)\\ V_{O_2}=0,1.22,4=2,24\left(l\right)\\ pthh:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
0,1 0,05
\(m_{KMnO_4}=0,1.158=15,8\left(g\right)\)

a) S + O2 --to--> SO2
b) \(n_S=\dfrac{1,6}{32}=0,05\left(mol\right)\)
PTHH: S + O2 --to--> SO2
0,05-->0,05--->0,05
=> VSO2 = 0,05.22,4 = 1,12 (l)
c)
PTHH: 2KClO3 --to--> 2KCl + 3O2
\(\dfrac{1}{30}\)<-----------------0,05
=> \(m_{KClO_3}=\dfrac{1}{30}.122,5=\dfrac{49}{12}\left(g\right)\)

`4H_2 + Fe_3 O_4` $\xrightarrow{t^o}$ `3Fe + 4H_2 O`
`n_{Fe} = (33,6)/56 = 0,6 (mol)`
`a.`
Theo phương trình: `n_{Fe_3 O_4} = 1/3n_{Fe} = 0,2 (mol)`
`-> m_{Fe_3 O_4} = 0,2 . 232 = 46,4 (g)`
`b.`
Theo phương trình: `n_{H_2} = 4/3n_{Fe} = 0,8 (mol)`
`-> V_{H_2} = 0,8 . 22,4 = 17,92 (l)`
`c.`
`2H_2 O` $\xrightarrow{\text{điện phân}}$ `2H_2 + O_2`
Theo phương trình: `n_{H_2 O} = H_2 = 0,8 (mol)`
`-> m_{H_2 O} = 0,8 . 18 = 14,4 (g)`
a) Khối lượng Fe3O4 cần dùng để điều chế 33,6 g Fe:
232 x 0,2 = 46,4 (g)
b) Thể tích khí cần dùng: 0,8 x 22,4 =17,92 (lít).

a) \(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: 3Fe + 2O2 --to--> Fe3O4
0,3<---0,2-------->0,1
=> m = 0,3.56 = 16,8 (g)
b) mFe3O4 = 0,1.232 = 23,2 (g)
c) Vkk = 4,48 : 20% = 22,4 (l)
nO2 = 4,48/22,4 = 0,2 (mol)
PTHH: 3Fe + 2O2 -> (t°) Fe3O4
Mol: 0,3 <--- 0,2 ---> 0,1
mFe = 0,3 . 56 = 16,8 (g)
mFe3O4 = 0,1 . 232 = 23,2 (g)
Vkk = 4,48 . 5 = 22,4 (l)

a) nFe = 16,8/56 = 0,3 (mol)
PTHH: 3Fe + 2O2 -> (t°) Fe3O4
Mol: 0,3 ---> 0,2 ---> 0,1
mFe3O4 = 0,1 . 232 = 23,2 (g)
b) VO2 = 0,2 . 22,4 = 4,48 (l)
Vkk = 4,48 . 5 = 22,4 (l)
c) H = 100% - 20% = 80%
nO2 (LT) = 0,2 : 80% = 0,25 (mol)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
nKMnO4 = 0,25 . 2 = 0,5 (mol)
mKMnO4 = 0,5 . 158 = 79 (g)

PTHH:\(3Fe\left(0,3\right)+2O_2\left(0,2\right)-t^o->Fe_3O_4\left(0,1\right)\)
nFe3O4= 23,2/160=0,1 mol
nFe =3.nFe3O4= 0,3 mol
mFe= 0,3.56=16,8 gam
b) \(2KClO_3-t^o->2KCl+3O_2\)
nO2-cần điều chế= 0,2 mol
vì lượng oxi bị hao 20% => nO2-điều chế thực tế: 0,2.120%=0,24 mol
nKClO3=( 0,24/3).2=0,16 mol
=> mKClO3= 0,16.122,5=19,6 gam
a) PTHH
3Fe + 2O2 \(\rightarrow\)Fe3O4 (1)
Có : nFe3O4 = 23,2/232 = 0,1(mol)
Theo PT(1) : nFe = 3. nFe3O4 = 3 . 0,1 = 0,3(mol)
=> mFe(cần dùng) = 0,3 . 56 = 16,8(g)
b) 2KClO3 \(\underrightarrow{t^o}\) 2KCl + 3O2 (2)
Theo PT(1) : nO2 = 2.nFe3O4 = 2 . 0,1 = 0,2(mol)
Để thu được thể tích khí oxi trên thì
nO2(thực tế ở PT2) = 0,2(mol)
mà bị hao hụt 20%
=> nO2(LT) = 0,2 + 20% . 0,2 = 0,24 (mol)
Theo PT(2) => nKClO3 = 2/3 . nO2(LT) = 2/3 . 0,24 =0,16 (mol)
=> mKClO3(cần dùng) =0,16. 122,5 = 19,6 (g)