Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt C%A=x(%)⇒C%B=2,5x(%)
Giả sử trộn 70g A với 30g B.
Trong A: mHCl=70.x%=0,7x(g)
Trong B: mHCl=30.2,5x%=0,75x(g)
⇒ΣmHCl=0,7x+0,75x=1,45x(g)
mdd=70+30=100g
⇒\(\dfrac{1,45x.100}{100}\)=25
⇔x=17,24
Vậy C%A=17,24%,C%B=43,1%

Tham khảo
https://hoc247.net/cau-hoi-hoa-tan-naoh-ran-vao-nuoc-de-tao-thanh-2-dung-dich-a-va-b--qid95961.html

a/ 1/10 dd C ứng với 0,1 lit.
HCl + AgNO3 --> AgCl + HNO3
nHCl = nAgCl = 8,61 / 143,5 = 0,06 mol
=> CM(C) = 0,06 / 0,1 = 0,6 mol / l
b/ Gọi Ca, Cb là nồng độ mol của ddA và ddB.
gt: Ca = 4*Cb (1)
mặt khác:
nHCl(A) = (1/3)*Ca
nHCl(B) = (2/3)*Cb
nHCl(C) = 1*0,6 = 0,6
ta có:
(1/3)*Ca + (2/3)*Cb = 0,6
=> Ca + 2*Cb = 1,8 (2)
Giải hệ (1), (2):
4*Cb + 2*Cb = 1,8
=>Cb = 0,3 M
Ca = 1,2 M

A) Viết phương trình hoá học:
Khi kẽm (Zn) tác dụng với axit clohidric (HCl), sẽ tạo ra khí hidro (H2) và muối kẽm clorua (ZnCl2).
Phương trình hoá học cho phản ứng này là:
Zn + 2HCl -> ZnCl2 + H2
B) Tính nồng độ mol của dung dịch HCl:
Dựa vào phương trình hoá học, 1 mol kẽm (Zn) reaguje với 2 mol axit clohidric (HCl) để tạo ra 1 mol khí hidro (H2) và 1 mol muối kẽm clorua (ZnCl2).
Dựa vào thông tin bạn đã cung cấp, chúng ta có 2,24 lít khí H2 (đktc), tức là chúng ta có 2,24 mol khí H2 (vì 1 mol khí ở điều kiện tiêu chuẩn có thể có thể thể tích 22,4 lít).
Vì mỗi mol khí H2 tạo ra tương ứng với 2 mol HCl, nên nồng độ mol của dung dịch HCl là:
Nồng độ mol HCl = 2 x 2,24 mol = 4,48 mol/L
C) Tính nồng độ mol của dung dịch A:
Theo phương trình hoá học, mỗi mol kẽm (Zn) tạo ra 1 mol muối kẽm clorua (ZnCl2). Vì vậy, nồng độ mol của dung dịch A cũng là 4,48 mol/L, giống như nồng độ mol của dung dịch HCl.
D) Tính khối lượng của kẽm:
Theo phương trình hoá học, 1 mol kẽm (Zn) tạo ra 1 mol muối kẽm clorua (ZnCl2). Vì vậy, khối lượng của kẽm (Zn) bằng khối lượng muối kẽm clorua (ZnCl2).
Để tính khối lượng muối ZnCl2, bạn cần biết khối lượng mol của nó. Để làm điều này, bạn cần biết trọng lượng nguyên tử của mỗi nguyên tố trong muối ZnCl2:
Khối lượng nguyên tử của Zn (kẽm) = 65,38 g/molKhối lượng nguyên tử của Cl (clor) = 35,45 g/mol (x 2 vì có 2 nguyên tử clor)Khối lượng mol của ZnCl2 = (65,38 g/mol + 2 x 35,45 g/mol) = 136,28 g/mol
Bây giờ chúng ta có thể tính khối lượng muối kẽm clorua (ZnCl2):
Khối lượng muối ZnCl2 = Nồng độ mol x Thể tích = 4,48 mol/L x 0,3 L = 1,344 mol
Khối lượng muối ZnCl2 = 1,344 mol x 136,28 g/mol = 183,13 g
Vậy khối lượng của kẽm (Zn) là 183,13 g.
\(n_{H2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
a) Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,1 0,2 0,1 0,1
b)\(C_{MddHCl}=\dfrac{0,2}{0,3}=0,67\left(M\right)\)
c) \(C_{MZnCl2}=\dfrac{0,1}{0,3}=0,33\left(M\right)\)
d) \(m_{Zn}=0,1.65=6,5\left(g\right)\)
Chúc bạn học tôt

đặt nồng độ mol của dd a là a , dd b la b. khi trộn 3 l a (có 3a mol) với 2 lit b (có 2b mol) được 5 lit dd x có dư axit. trung hoà 5 lit dd x cần
nKOH =0,2.5 = 1mol -> số mol H2SO4 dư: 0,5 mol.
H2SO4+ 2KOH -> K2SO4 +2 H2O
b-------------- 2b
số mol h2so4 dư = 3a – b = 0,5*
trộn 2l dd a (có 2a mol) với 3 lít ddb (có 3b mol) tạo 5 l dd y có koh dư. trung hoà 5 lit y cần 0,2 .5 = 1 mol hcl
pt: H2SO4 + 2KOH -> K2SO4 + 2H2O
2a---------------- 4a
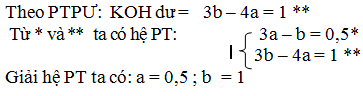

Gọi x là nHCl, y là nH2SO4
nNaOH=0.5.0.04=0.02mol
=>nOH-=0.02mol
PT:
H(+)+OH(-)-->H2O
0.02<0.02
=>nH+ trong 10ml hh axit=0.02
=>nH+ trong 100ml hh axit=0.02.10=0.2mol
PT:
H(+)+OH(-)-->H2O
0.2->0.2
=>nNaOH=0.2mol
m muối=mNa(+)+mCl(-)+mSO4(2-)=23.0.2+35.5x...
< = > 35.5x+96y=8.6 (1)
Ta lại có: nH+=x+2y=0.2 (2)
Từ (1)(2)=>x=0.08, y=0.06.
Vậy [HCl]=0.08M, [H2SO4]=0.06M.
Giải rõ nhé!!!!!!!!!
Đặt x, y lần lượt là nồng độ mol/lit của axit H2SO4 và axit HCl
Viết PTHH.
Lập hệ phương trình:
2x + y = 0,02 (I)
142x + 58,5y = 1,32 (II)
Giải phương trình ta được:
Nồng độ của axit HCl là 0,8M và nồng độ của axit H2SO4 là 0,6M.

Chị giúp em 2 cách, nếu thấy cách nào dễ hiểu mà dễ dùng thì hãy áp dụng, không cần thiết phải gượng ép cách nào cả =))
Cách 2 chị không quen nên còn không nắm chắc cách dùng , thế nên chỉ toàn làm cách 1 , thế đấy.
* Cách 1: Gọi đặt ẩn rồi rút ẩn. Ap dụng công thức tính nồng độ mol.
Gọi 2a là thể tích dung dịch A (2a > 0, lít)
=> Thể tích dung dịch B là 3a (lít)
\(\Rightarrow\left\{{}\begin{matrix}n_A=0,3.2a=0,6a\left(mol\right)\\n_B=0,6.3a=1,8a\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_C=0,6a+1,8a=2,4a\left(mol\right)\)
Ta có \(V_{ddC}=V_{ddA}+V_{ddB}=2a+3a=5a\left(lit\right)\)
\(\Rightarrow C_{M_C}=\dfrac{2,4a}{5a}=0,48\left(M\right)\)
* Cách 2: ÁP dụng phương pháp đường chéo
Gọi x là nồng độ mol của dung dịch C
Ta có: \(\dfrac{2}{3}=\dfrac{0,6-x}{x-0,3}\)
\(\Rightarrow x=0,48\left(M\right)\)
nhờ chị giải thích c2 cho em cái. em cảm ơn ạ