Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

có ai giải cho bài này được ko?
3. BẰng phương pháp hóa học, hãy trình bày cách phân biệt 3 kim loại riêng biệt sau: BẠc, nhôm, sắt. Viết PTHH của các phản ứng xảy ra (nếu có).
(Các dụng cụ, hóa chất cần thiết coi như có đủ).
cho td vs NaOH : kl nào tan x hiện khí k màu H2 bay lên thì là Al
cho 2kl còn lại td vs HCl, kl nào có htg sủi bọt và bay hơi thì là Fe còn lại là Ag

trên mạng mk thấy có một bài tượng tự trên hocmai, bạn vào đó tham khảo nhé
Nhưng mà bài đó không phải là tính số mol mà tính nồng độ phần trăm mình xem bài đó rồi bạn

* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư. Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
P/ư: x x x x mol
Khối lượng lá sắt tăng = 2,58 - 2,5 = 0,08 gam. Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b) Sô mol CuS04 ban đầu = 0,02625 mol
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:
mdd = + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 = .100% ≈ 9,32%
C%, FeSO4 = .100% ≈ 5,45%
* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư.
Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
1 mol Fe phản ứng thì khối lượng sắt tăng: 64-56 = 8 gam
x mol Fe → 2,58 -2,5 = 0,08 gam
⇒ x = 0,01 mol
b) Số mol CuSO4 ban đầu
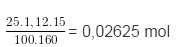
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:


mddCuSO4 = 25.1,12 = 28g
⇒mCuSO4 = 4,2g
⇒nCuSO4 = 0,02625mol
Fe + CuSO4→→ FeSO4 + Cu
x →→ x-----------------x---------x
mtăng = 64x-56x = 0,08g
⇒ x=0,01mol
nFe(bđ)= 5/112 mol ⇒⇒ Fe dư, CuSO4 dư ( vì phản ứng ko hoàn toàn)
⇒⇒trong dd sau pứ có FeSO4=0,01mo; CuSO4=0,01625mol
mdd = mCuSO4 + mFepư - mCu = mddCuSO4 - mgiảm =28 - 0,08 = 27,92g
⇒ C% FeSO4 = 0,01(56 + 96).100/ 27,92 = 5,44%
C% CuSO4 = 0,01625.(64 + 96).100/27,92 = 9,31%

Khối lượng dung dịch CuSO 4 : m dd CuSO 4 = 1,12 x 50 = 56 (gam).
CuSO 4 + Fe → FeSO 4 + Cu
64x — 56x = 5,16 - 5 = 0,16 (gam) => x = 0,02 mol.
m CuSO 4 tham gia phản ứng = 0,02 x 160 = 3,2 (gam);
100 gam dung dịch CuSO 4 có 15 gam CuSO 4 nguyên chất.
56 gam dung dịch CuSO 4 có X gam CuSO 4 nguyên chất.
x = 56 x 15/100 = 8,4g; m CuSO 4 còn lại = 8,4 - 3,2 = 5,2g
m FeSO 4 = 0,02 x 152 = 3,04g
m dd sau p / u = 56 - 0,16 = 55,84g
C % CuSO 4 = 5,2/55,84 x 100% = 9,31%
C % FeSO 4 = 3,04/55,84 x 100% = 5,44%

a, \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
____x_______x________x_____x (mol)
b, Ta có: m lá sắt tăng = mCu - mFe
⇒ 2,58 - 2,5 = 64x - 56x
⇒ x = 0,01 (mol)
Ta có: mCuSO4 = 25.1,12 = 28 (g) \(\Rightarrow n_{CuSO_4}=\dfrac{28.15\%}{160}=0,02625\left(mol\right)\)
Theo PT: \(n_{FeSO_4}=n_{CuSO_4\left(pư\right)}=n_{Cu}=0,01\left(mol\right)\)
Có: m dd sau pư = 2,5 + 28 - 2,58 = 27,92 (g)
Dung dịch sau pư gồm: FeSO4: 0,01 (mol) và CuSO4: 0,01625 (mol)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeSO_4}=\dfrac{0,01.152}{27,92}.100\%\approx5,44\%\\C\%_{CuSO_4}=\dfrac{0,01625.160}{27,92}.100\%\approx9,31\%\end{matrix}\right.\)

mdd CuSO4 = 50 . 1,12 = 56 g
=> nCuSO4 = 56. 15% / 160 = 0,0525 mol
m kim loại tăng = 0,16 g
PTHH: Fe + CuSO4 -> FeSO4 + Cu
x........x............x...............x
m kim loại tăng = 64x - 56x = 0,16
-> x = 0,02
-Dd sau pư bao gồm: CuSO4 dư (0,0525 - 0,02 = 0,0325 mol); FeSO4 (0,02 mol)
-Khối lượng kim loại tăng -> Khối lượng dd giảm
=>mdd sau pư = 56 - 0,16 = 55,84 g
=> C% dd CuSO4 dư =(0,0325 . 160 . 100% ) : 55,84 = 9,31%
C% dd FeSO4 = (0,02 . 152 . 100%) : 55,84 = 5,44%
Vậy ...
mCuSO4(dd) = 50 . 1,12 = 56 g => mCuSO4 = \(\dfrac{56.15}{100}\)= 8,4 g
=>nCuSO4 = \(\dfrac{8,4}{160}\)= 0,0525 mol
nFe = \(\dfrac{5}{56}\)= 0,089 mol
Fe + CuSO4 -> FeSO4 + Cu
0,089(dư);0,0525(hết) -> 0,0525 mol
=>C%(FeSO4) = \(\dfrac{0,0525.152}{5+0,16+8,4}\).100% \(\approx\) 58,85%
Bài 3 :
Ta lấy mỗi kim loại một ít ra làm thuốc thử
+ Đầu tiên nhỏ vài giọt dd NaOH vào 3 mẫu kim loại thì Al sẽ tác dụng
=> PTHH : \(2Al+2NaOH+2H_2O\rightarrow2NaAlO_3+3H_2\)
+ Còn lại 2 kim loại là Ag và Fe ta cho tác dụng với dd axit HCl , thì Fe xảy ra phản ứng :
PTHH : Fe + 2HCl -> FeCl2 + H2↑
+ còn lại kim loại khi cho tác dụng với ddHCl mà ko xảy ra p/ứ là Ag.
Bài4 :
* Ứng dụng của gang :
+ Gang xám chứa cacbon ở dạng than chì, đúc bệ máy, vô lăng
+ Gang trắng chứa ít cacbon và cacbon chủ yếu ở dạng xementit (Fe3C) => luyện thép
* Ứng dụng của thép :
+ Thép mềm : làm thép sợi, đinh, bu lông, thép lá
+ Thép cứng : làm các công cụ, 1 số kết cấu và chi tiết máy