Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
R → RSO4
mSO4 = 30,4 – 11,2 = 19,2 => nR = nSO4 = 19,2/96 = 0,2 => R = 11,2/0,2 = 56

n Al = a(mol) ; n Fe = b(mol)
=> 27a + 56b = 20,65(1)
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
a...........1,5a............0,5a............1.5a..(mol)
Fe + H2SO4 → FeSO4 + H2
b...........b..............b............b......(mol)
=> n H2 = 1,5a + b = 0,725(2)
Từ 1,2 suy ra a = 0,35 ; b = 0,2
Suy ra :
%m Al = 0,35.27/20,65 .100% = 45,76%
%m Fe = 100% -45,76% = 54,24%
m H2SO4 = (1,5a + b).98 = 71,05 gam
m muối = m kim loại + m H2SO4 -m H2 = 20,65 + 71,05 -0,725.2 = 90,25 gam

\(n_R=\dfrac{5,4}{R}\left(mol\right)\)
\(2R\left(\dfrac{5,4}{R}\right)+3H_2SO_4\left(\dfrac{8,1}{R}\right)\rightarrow R_2\left(SO_4\right)_3\left(\dfrac{2,7}{R}\right)+3H_2\left(\dfrac{8,1}{R}\right)\)
Theo PTHH \(n_{R_2\left(SO_4\right)_3}=\dfrac{2,7}{R}\left(mol\right)\)
\(\Rightarrow m_{R_2\left(SO_4\right)_3}=\dfrac{2,7.\left(2R+288\right)}{R}\left(g\right)\) \(\left(1\right)\)
\(n_{H_2}=\dfrac{8,1}{R}\left(mol\right)\)
\(\Rightarrow m_{H_2}=\dfrac{16,8}{R}\left(g\right)\)
\(m_{ddsau}=5,4+395,2-\dfrac{16,8}{R}\left(g\right)\)
Theo đề dung dịch muối sau phản ứng có nồng độ 8,55%
\(\Rightarrow8,55=\dfrac{\dfrac{2,7.\left(2R+288\right)}{R}}{5,4+395,2-\dfrac{16,8}{R}}.100\)
\(\Rightarrow R=27\left(Al\right)\)
Theo PTHH: \(n_{H_2SO_4}=\dfrac{8,1}{R}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=29,4\left(g\right)\)
\(\Rightarrow C\%_{H_2SO_4}\left(bđ\right)=\dfrac{29,4}{395,2}.100=7,44\%\)

Gọi x là số mol của kim loại R:
PTHH: R + 2HCl -----> RCl2 +H2
x mol
=>MR= 4/x đvC (*)
Khi cho hỗn hợp Zn và R vào dd H2SO4:
nH2= 13.44/22.4=0.6 mol
PTHH: R + H2SO4 ---> RSO4+ H2
x x
Zn +H2SO4 ----> ZnSO4 + H2
y y
Kết hwpj với (*) ,ta có hệ pt: \(\left\{{}\begin{matrix}\dfrac{4}{x}+65y=22.2\\x+y=0.6\end{matrix}\right.\)
giải ra : x =0.489432167 ; y = 0.1910567833
mZn=0.1910567833*65= 12.41g
=>mR=22.2-12.41=9.79g
=>MR=9.79/0.489432167 \(\approx\) 24 đvC (Mg)
Vậy kim loại R cần tìm là Mg.
(Số mol tính ra giữ nguyên, chỉ làm tròn ở kết quả cưới cùng để tránh sai số).

Cho hh 2 muối tác dụng với H2SO4 loãng
MgCO3 + H2SO4 → MgSO4 + H2O + CO2
RCO3 + H2SO4 → RSO4 + H2O + CO2
Số mol khí CO2 sinh ra: n(CO2 1) = 4,48/22,4 = 0,2mol
Nung chất rắn không tan sau pư thấy thoát ra khí CO2 → muối cacbonat dư → H2SO4 đã tham gia phản ứng hết.
Số mol H2SO4 đã dùng: n(H2SO4) = n(CO2) = 0,2mol
Nồng độ dung dịch H2SO4: C(H2SO4) = 0,2/0,5 = 0,4M
b./ Theo ĐL bảo toàn khối lượng:
m(hh muối) + m(H2SO4) = m(muối khan) + m(B) + m(CO2) + m(H2O)
→ m(B) = m(hh muối) + m(H2SO4) - m(muối khan) - m(CO2) - m(H2O) = 115,3 + 0,2.98 - 12.2 - 0,2.44 - 0,2.18 = 110,3g
c./ Số mol CO2 thu được khi nung B: n(CO2 2) = 11,2/22,4 = 0,5mol
Tổng số mol hai muối:
n(hh muối) = n(MgCO3) + n(RCO3) = n(CO2 1) + n(CO2 2) = 0,2 + 0,5 = 0,7mol
n(RCO3) = 2,5.n(MgCO3) → n(MgCO3) = 0,2mol và n(RCO3) = 0,5mol
Khối lượng mỗi muối:
m(MgCO3) = 84.0,2 = 16,8g
m(RCO3) = m(hh muối) - m(MgCO3) = 115,3 - 16,8 = 98,5g
Khối lượng mol phân tử của muối cacbonat cần tìm:
M(RCO3) = R + 60 = m(RCO3)/n(RCO3) = 98,5/0,5 = 197
→ R = 137
Vậy kim loại cần tìm là Ba.

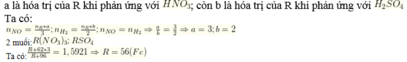
B1:
Gọi kim loại cần tìm là R
PTHH
2R+ xH2SO4----->R2(SO4)x +xH2
Ta có
n\(_{H2}=\frac{4,48}{22,4}=0,2\left(mol\right)\)
Theo pthh
n\(_R=\frac{2}{x}n_{H2}=\frac{0,4}{x}\left(mol\right)\)
M\(_R=\frac{4,48}{0,4:x}=\frac{11,2}{x}\left(\frac{g}{mol}\right)\)
Ta có
Bạn xem lại đề thử nhé