Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Ba\left(OH\right)_2}=0,88\cdot0,125=0,11mol\)
PTHH: \(H_2+Cl_2\rightarrow2HCl\)
\(2HCl+Ba\left(OH\right)_2\rightarrow BaCl_2+2H_2O\)
Ta có: \(n_{HCl}=2n_{Ba\left(OH\right)_2}=2\cdot0,11=0,22mol\)
\(HCl+AgNO_3\rightarrow AgCl\downarrow+HNO_3\)
Ta có: \(n_{HCl}=n_{AgNO_3}=0,22mol\)
\(\rightarrow M_{AgCl}=\frac{31,57}{0,22}=143,5u\)
\(\rightarrow M_{Cl}=35,5u\)
\(Cl\left\{{}\begin{matrix}^{35}Cl:x\%\\^{37}Cl:y\%\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}\frac{35x+37y}{x+y}=35,5\\x+y=100\end{matrix}\right.\Leftrightarrow}\left\{{}\begin{matrix}x=75\%\\y=25\%\end{matrix}\right.\)
Khúc cuối hình như bị lỗi 1 xíu nên bạn tự giải tiếp nha

Câu 1:
\(H_2+Cl_2\rightarrow2HCl\left(1\right)\)
___0,03______0,06
\(HCl+AgNO_3\rightarrow AgCl+HNO_3\)
\(n_{AgCl}=\frac{0,17}{108+35,5}\)
\(n_{HCl\left(1\right)}=\frac{0,17}{108+35,5}.\frac{20}{5}=\frac{34}{7175}\)
\(n_{H2}=\frac{1}{22,4}\)
\(n_{Cl2}=\frac{0,672}{22,4}=0,03\left(mol\right)\)
\(\Rightarrow H=\frac{\frac{34}{7145}}{0,06}.100\%=7,9\%\)
Câu 3:
\(n_{NaCl}=\frac{12,87}{23+35,5}=0,22\left(mol\right)\)
\(2NaCl+H_2SO_4\rightarrow Na_2SO_4+2HCl\)
0,22____________0,11___________0,22
\(n_{NaCl}=n_{HCl}=0,22\left(mol\right)\)
\(\Rightarrow V_{HCl}=0,22.22,4.90\%=4,43521\)
\(m_{Na2SO4}=0,11.142.90\%=14,058\left(g\right)\)

a/ PTHH: R + 2HCl ===> RCl2 + H2
nH2 = 2,688 / 22,4 = 0,12 (mol)
nR = nH2 = 0,12 mol
=> MR = 6,72 / 0,12 = 56 (g/mol)
=> R là Fe

nCu= x mol; nAg= y mol
Cu + 2H2SO4→ CuSO4 + SO2↑ + H2O (1)
2Ag + 2H2SO4→ Ag2SO4 + SO2↑ + 2H2O (2)
SO2(k) + Br2 + 2H2O → H2SO4 + 2HBr (3)
BaCl2 + H2SO4 → BaSO4↓ + 2HCl (4)
Theo PTPU (4), ta có: n↓= nBaSO4= nH2SO4 (4)= 0,08 mol
Theo PTPU (3), ta có: nSO2= nH2SO4 (4)= 0,08 mol
Theo PTPU (1) và (2), ta có: nSO2= nCu + 2nAg = x + 0,5y = 0,08 mol (5)
Tổng khối lượng hỗn hợp ban đầu: mhỗn hợp= mCu + mAg = 64x + 108y = 11,2 (6)
Giải hệ hai phương trình (5) và (6) ta được: x= 0,04 ; y= 0,08
→mCu= 0,04x64= 2,56 (g) →%mCu=2,56/11,2x100% = 22,86%
→%mAg= 100% - %mCu= 77,14%

Bài 1:
Giả sử 2 muối NaX và NaY đều cho kết tủa:
Ta có
\(NaM+AgNO_3\rightarrow AgX+NaNO_3\)
\(m_{tang}=\left(108-23\right).nM=8,61-6,03\)
\(\rightarrow n_M=0,03\left(mol\right)\)
\(M_M=\frac{6,03}{0,03-23}=175,6\)
Không có một halogen nào thỏa mãn.
Phải có một muối là NaF (AgF không kết tủa), vì là 2 halogen thuộc 2 chu kì liên tiếp nên Y là Cl
\(n_{AgCl}=\frac{8,61}{143,5}=0,06\left(mol\right)\)
\(\rightarrow n_{NaCl}=0,06\left(mol\right)\)
\(\rightarrow m_{NaF}=6,03-0,06.58,5=2,52\left(g\right)\)
\(\%m_{NaF}=\frac{2,52}{6,03}.100\%=41,79\%\)
Bài 2:
Spu, \(m_{giam}=m_{Br^-}-m_{Cl}=1,6-1,155=0,445\left(mol\right)\)
Gọi x là mCl- thì x+0,445 là mBr-
\(Cl_2+2Br^-\rightarrow Br_2+2Cl^-\)
\(\rightarrow n_{Cl^-}=n_{Br^-}\)
\(\Leftrightarrow\frac{x}{35,5}=\frac{x+0,445}{80}\)
\(\rightarrow35,5.\left(x+0,445\right)=80x\)
\(\Leftrightarrow x=0,355\)
\(n_{Cl^-}=\frac{0,335}{35,5}\left(mol\right)\)
\(\rightarrow n_{Cl2}=\frac{0,335}{71}\left(mol\right)\)
\(\rightarrow m_{Cl2}=0,335\left(g\right)\)
\(\%_{Cl2}=\frac{0,335.100}{5}=6,7\%\)
Bài 4:
Chất ko tan là Cu
\(\rightarrow m_{Mg,Al}=10,14-6,4=3,74\left(g\right)\)
\(n_{H2}=0,35\left(mol\right)\)
\(\rightarrow n_{HCl}=2n_{H2}=0,7\left(mol\right)=n_{Cl}\)
\(\rightarrow m_{Cl}=24,85\left(g\right)\)
\(m_{muoi}=3,75+24,85=29,59\left(g\right)\)

1.a. Sơ đồ các quá trình phản ứng
Kim loại + Oxi \(\rightarrow\) (hỗn hợp oxit ) + axit \(\rightarrow\) muối + H2O
Từ quá trình trên => số mol H2SO4 phản ứng = số mol oxi trong oxit
Theo bài ta có: moxi = 39,2 – 29,6 = 9,6(g)
=> \(n_O=\frac{9,6}{16}=0,6mol\)
=> số mol H2SO4 phản ứng = 0,6 (mol)
b. Khối lượng muối = khối lượng kim loại + khối lượng gốc sunfat
=> mm = 29,6 + 96. 0,6 = 87,2 (g)
2. Gọi công thức của oxit cần tìm là MxOy
Phương trình phản ứng.
MxOy + yH2 \(\rightarrow\) xM + yH2O (1)
\(n_{H_2}=\frac{985,6}{22,4.1000}=0,044\left(mol\right)\)
Theo định luật bảo toàn khối lượng
=> khối lượng kim loại = 2,552 + 0,044.2 – 0,044.18 = 1,848(g)
Khi M phản ứng với HCl
2M + 2nHCl \(\rightarrow\) 2MCln + nH2 (2)
\(n_{H_2}=\frac{739,2}{22,4.1000}=0,033\left(mol\right)\)
(2) => \(\frac{1,848}{M}.n=2.0,033\)
=> M = 28n
Với n là hóa trị của kim loại M
Chỉ có n = 2 với M = 56 (Fe) là thỏa mãn
Theo (1) \(\frac{x}{y}=\frac{n_M}{n_{H_2}}=\frac{0,033}{0,044}=\frac{3}{4}\)
=> oxit cần tìm là Fe3O4
1.a. Sơ đồ các quá trình phản ứng
Kim loại + Oxi (hỗn hợp oxit ) + axit muối + H2O
Từ quá trình trên => số mol H2SO4 phản ứng = số mol oxi trong oxit
Theo bài ta có: moxi = 39,2 – 29,6 = 9,6(g)
=>
=> số mol H2SO4 phản ứng = 0,6 (mol)
b. Khối lượng muối = khối lượng kim loại + khối lượng gốc sunfat
=> mm = 29,6 + 96. 0,6 = 87,2 (g)
2. Gọi công thức của oxit cần tìm là MxOy
Phương trình phản ứng.
MxOy + yH2 xM + yH2O (1)
Theo định luật bảo toàn khối lượng
=> khối lượng kim loại = 2,552 + 0,044.2 – 0,044.18 = 1,848(g)
Khi M phản ứng với HCl
2M + 2nHCl 2MCln + nH2 (2)
(2) =>
=> M = 28n
Với n là hóa trị của kim loại M
Chỉ có n = 2 với M = 56 (Fe) là thỏa mãn
Theo (1)
=> oxit cần tìm là Fe3O4

Đáp án D
Gọi phần trăm số nguyên tử của X 17 35 là x, X 17 37 là (100 – x).
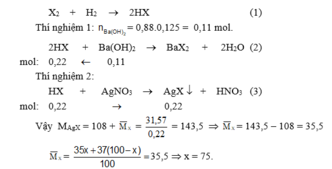
Vậy thành phần phần trăm mỗi loại đồng vị của clo là : C 17 35 l (75% ) ; C 17 37 l (25%).

Pt tác dụng H2SO4 loãng
CuO + H2SO4 \(\rightarrow\) CuSO4 + H2O (1)
Cu không tác dụng.
Cu + 2H2SO4đặc,n \(\rightarrow\) CuSO4 + SO2 + 2H2O (2)
nSO2= \(\frac{1,12}{22,4}\) = 0,05 mol
\(\rightarrow\) nCu= nSO2= 0,05 mol
% Cu = \(\frac{0,05x64}{10}.100\%\)= 32%
\(\rightarrow\) % CuO = 68%.
Gọi phần trăm số nguyên tử của \(^{35}Cl\) là x, \(^{37}Cl\)là (100 – x).
Cl2 + H2 ------> 2HCl (1)
\(\overline{M_{Cl}}=\dfrac{35x+37\left(100-x\right)}{100}=35,5\)
=> x = 75
Vậy thành phần phần trăm mỗi loại đồng vị của clo là : 35Cl(75% ); 37Cl(25%).