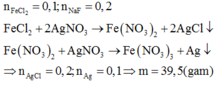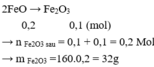Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
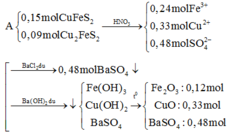
Ta có:
Fe + 2HCl→ FeCl2 + H2
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
![]()
![]()
Bảo toàn Fe: nFe bđ = 0,2 + 0,2.3 = 0,8
2Fe → Fe2O3
0,8 → 0,4
=> m = 0,4.160 = 64 (g)

- Chất rắn không tan trong HCL dư là S => m S dư = 3,8g
Kết tủa đen là CuS => n CuS = 0,1 = n H 2 S = nS phản ứng
m S phản ứng = 3,2g
0,2 mol Z gồm 0,1 mol H 2 S và 0,1 mol H 2
m ban đầu = 3,8 + 3,2 = 7g
Ta lại có
n Fe p / u = n S p / u = 0,1 mol
n Fe dư = n H 2 = 0,1 mol
n Fe ban đầu → m Fe ban đầu = 0,2 .56 = 1,12 g
Vậy m = 11,2 + 0,7 = 18,2 (gam)

\(n_{FeCl_2}=0,1;n_{NaCl}=0,2\)
\(\Rightarrow n_{Cl-}=0,4;n_{Fe^{2+}}=0,1\)
Cho dd \(AgNO_3\)(dư) vào dd X, sau khi phản ứng xảy ra hoàn toàn sinh ra m gam chất rắn.
Chất rắn gồm: \(AgCl\left(0,4\right);Ag\left(0,1\right)\)
\(m=0,4\left(108+35,5\right)+0,1.108=68,2\\ \rightarrow A\)