Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Mặc dù HBr có khối lượng phân tử lớn hơn so với HF, nhưng nhiệt độ nóng chảy và nhiệt độ của HBr thấp hơn so với HF.
Do trong phân tử HF có các liên kết hydrogen, còn HBr không có liên kết hydrogen. Để phá vỡ được các liên kết hydrogen liên phân tử trong HF cần phải cung cấp năng lượng để phá vỡ liên kết và động năng để phân tử chuyển động nhiều hơn so với phân tử HBr. Khi đó nhiệt độ nóng chảy, nhiệt độ sôi của HF đều lớn hơn HBr.
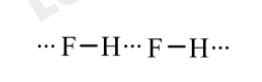

| Tên hoá chất | Công thức hoá học | Công thức cấu tạo | Loại liên kết |
| Hiđro | \(H_2\) | \(H-H\) | Cộng hoá trị không cực |
| Oxi | \(O_2\) | \(O=O\) | Cộng hoá trị không cực |
| Ozon | \(O_3\) | \(O=O\rightarrow O\) | Cộng hoá trị không cực |
| Nitơ | \(N_2\) | \(N\equiv N\) | Cộng hoá trị không cực |
| Cacbon monoxit | \(CO\) | C O | Cộng hoá trị có cực |
| Cacbon đioxit | \(CO_2\) | \(O=C=O\) | Cộng hoá trị không cực |
| Nước | \(H_2O\) | \(H-O-H\) | Cộng hoá trị có cực |
| Liti florua | \(LiF\) | \(Li^+\cdot\cdot\cdot\cdot\cdot F^-\) | Liên kết ion |
| Flo | \(F_2\) | \(F-F\) | Cộng hoá trị không cực |
| Clo monoflorua | \(ClF\) | \(Cl-F\) | Cộng hoá trị có cực |
| Clo | \(Cl_2\) | \(Cl-Cl\) | Cộng hoá trị không cực |
| Lưu huỳnh đioxit | \(SO_2\) | \(O=S\rightarrow O\) | Cộng hoá trị có cực |
| Hiđro peroxit | \(H_2O_2\) | \(H-O-O-H\) | Cộng hoá trị có cực |
| Lưu huỳnh monoxit | \(SO\) | \(S=O\) | Cộng hoá trị có cực |

\(\Delta_rH^0_{298}=-542,83-167,16-\left(-795,0\right)=85,01\left(kJ\right)\)
\(\Delta_fH^0_{298}=-542,83-2.167,16-\left(-795,0\right)\) \(=-82,15\left(kJ\right)\)

Biến thiên enthalpy chuẩn của phản ứng trên là:
\(\Delta_rH^0_{298}=\) \(2.\Delta_fH^0_{298}\left(CO_2\right)+3.\Delta_fH^0_{298}\left(H_2O\right)-\Delta_fH^0_{298}\left(C_2H_6\right)-\Delta_fH^0_{298}\left(O_2\right)\)
\(=2.\left(-393,50\right)+3\left(-285,84\right)-\left(-84,70\right)=-1559,82\left(kJ\right)\)
ΔfH298=ΣΔ fH298(sp) - ΣΔfH298 (cd) = 2.(-393,5) + 3.(-285,84) - (-84,7) = -1559,82 kJ.
- Mặc dù HBr có khối lượng phân tử lớn hơn so với HF, nhưng nhiệt độ nóng chảy và nhiệt độ của HBr thấp hơn so với HF.
Do trong phân tử HF có các liên kết hydrogen, còn HBr không có liên kết hydrogen. Để phá vỡ được các liên kết hydrogen liên phân tử trong HF cần phải cung cấp năng lượng để phá vỡ liên kết và động năng để phân tử chuyển động nhiều hơn so với phân tử HBr. Khi đó nhiệt độ nóng chảy, nhiệt độ sôi của HF đều lớn hơn HBr.
- Điền công thức thích hợp vào ô có dấu ?
Chất
Nhiệt độ nóng chảy (oC)
Nhiệt độ sôi (oC)
HBr
–86,9
–66,8
HF
–83,6
19,5