Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

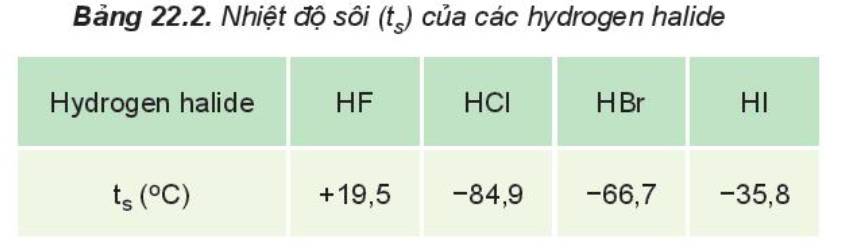
Từ Bảng 22.2 nhận thấy:
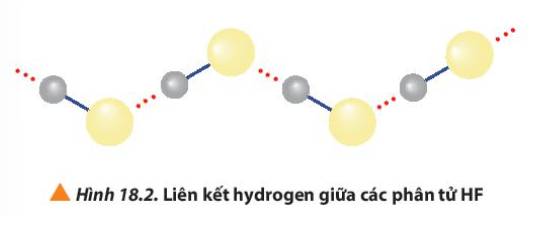
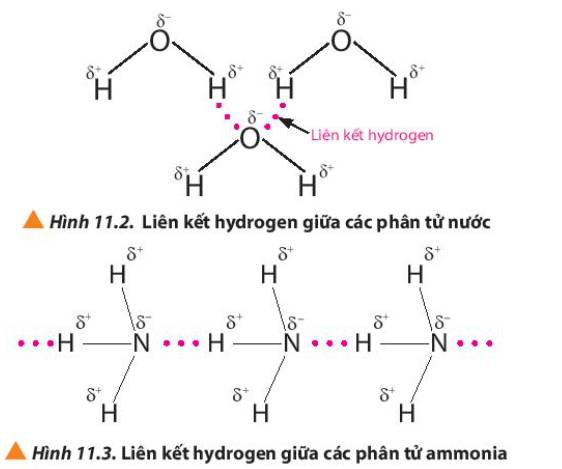
- HF lỏng có nhiệt độ sôi cao bất thường là do phân tử HF phân cực mạnh, có khả năng tạo liên kết hydrogen: H-F…H-F…H-F
- Từ HCl đến HI, nhiệt độ sôi tăng do:
+ Lực tương tác van der Waals giữa các phân tử tăng
+ Khối lượng phân tử tăng
nhiệt độ sôi tăng từ HI đến HF là do lực tương tác van der Waals giữa các phân tử tăng và khối lượng phân tử tăng.

Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI. Nguyên nhân là do khối lượng phân tử tăng, làm tăng năng lượng cần thiết cho quá trình sôi; đồng thời, sự tăng kích thước và số electron trong phân tử, dẫn đến tương tác van der Waals giữa các phân tử tăng
Nhiệt độ sôi tăng dần từ HCl đến HI
Giải thích:
-M tăng làm tăng năng lượng cần thiết cho quá trình sôi
-sự tăng kích thước và số electron trong phân tử dẫn đến tương tác van der Waals giữa các phân tử tăng.

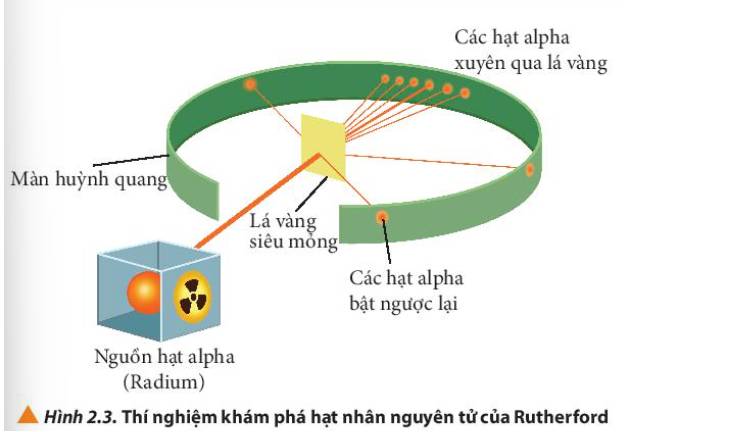
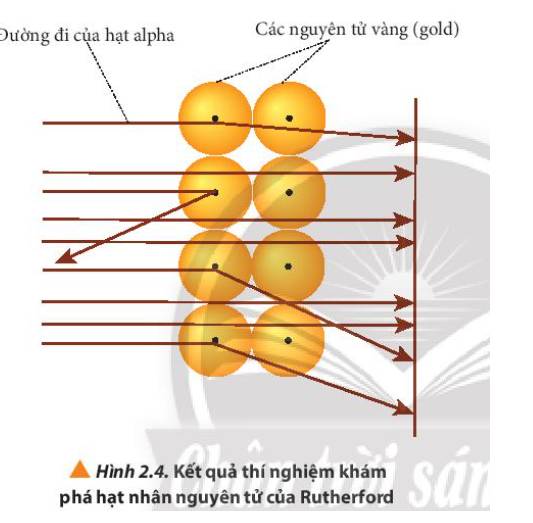
- Quan sát Hình 2.3 thấy được: hầu hết các hạt α đi thẳng, có vài hạt bị bắn theo đường gấp khúc
- Quan sát Hình 2.4 giải thích: các hạt α bị bắn theo đường gấp khúc là do va vào hạt nhân của nguyên tử vàng, các hạt không va vào hạt nhân thì đi thẳng
- Các hạt alpha hầu hết đều xuyên thẳng qua lá vàng, một số ít bị lệch hướng và một số rất ít bị bật ngược lại.
Giải thích: Do nguyên tử có cấu tạo rỗng, ở tâm chứa một hạt nhân mang điện tích dương có kích thước rất nhỏ so với kích thước nguyên tử nên hầu hết các hạt alpha có thể đi xuyên qua lá vàng.

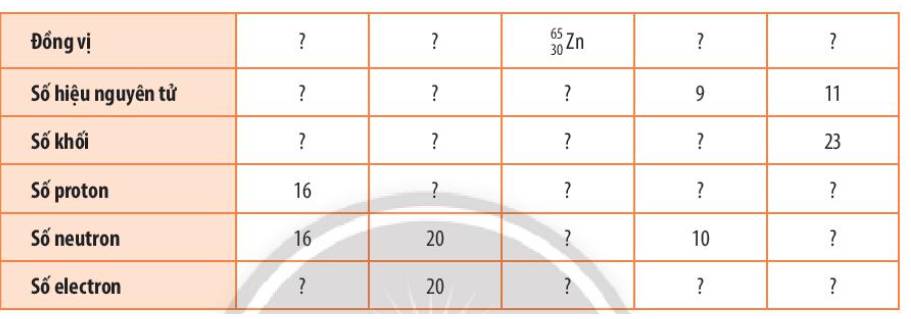
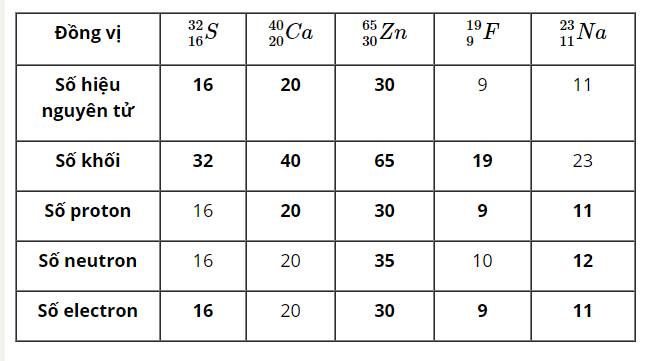
Hàng 1: \(^{32}_{16}S,^{40}_{20}Ca,^{65}_{30}Zn,^{19}_9F,^{23}_{11}Na\)
Hàng 2: 16, 20, 30, 8, 11
Hàng 3: 32, 40, 65, 18, 23
Hàng 4: 16, 20, 30, 9, 11
Hàng 5: 16, 20, 35, 10, 12
Hàng 6: 16,20,30,9,11

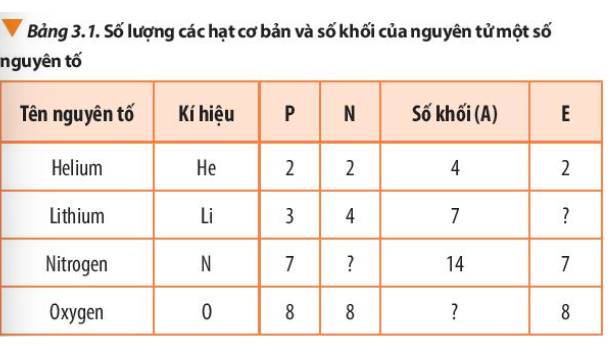
Số khối A = số proton (P) + số neutron (N)
Số electron (E) = Số proton (P)
Tên nguyên tố | Kí hiệu | P | N | Số khối (A) | E |
Helium | He | 2 | 2 | 4 | 2 |
Lithium | Li | 3 | 4 | 7 | 3 |
Nitrogen | N | 7 | 7 | 14 | 7 |
Oxygen | O | 8 | 8 | 16 | 8 |

Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết

- Hiệu độ âm điện của C và H là 2,55 – 2,2 = 0,35 nên liên kết C - H trong phân tử CH4 là liên kết cộng hóa trị không phân cực.
- Hiệu độ âm điện của Cl2 và Ca là 3,16 – 1,1 = 2,06 nên liên kết Ca – Cl trong phân tử CaCl2 là liên kết ion.
- Hiệu độ âm điện của Br và H là 2,96 – 2,2 = 0,76 nên liên kết H – Br trong phân tử HBr là liên kết cộng hóa trị phân cực .
- Hiệu độ âm điện của N và H là 3,04 – 2,2 = 0,84 nên liên kết N – H trong phân tử NH3 là liên kết cộng hóa trị phân cực.

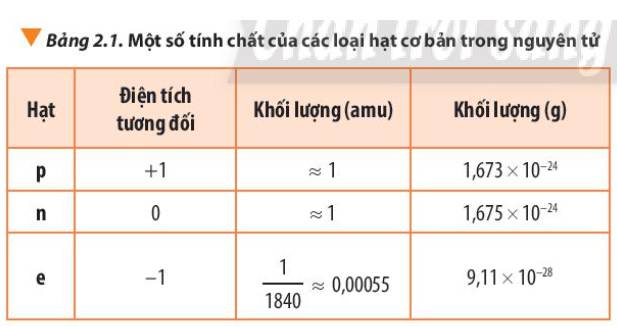
Ta có:
\(\dfrac{m_P}{m_e}=\dfrac{1}{\dfrac{1}{1840}}=1840\left(lần\right)\)
Kết quả này cho thấy khối lượng của các hạt electron không đáng kể so với khối lượng của proton và neutron, do đó khối lượng của nguyên tử gần bằng khối lượng của hạt nhân.
Tỉ lệ khối lượng 1 proton với 1 electron:
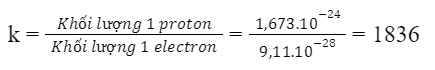
=> Khối lượng 1 electron nhỏ hơn rất nhiều so với khối lượng 1 proton
=> Có thể coi khối lượng nguyên tử = khối lượng hạt nhân do khối lượng của electron không đáng kể so với khối lượng của proton và neutron
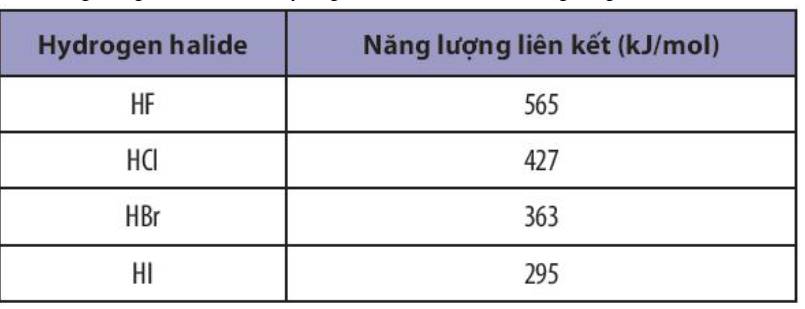


- Sắp xếp theo chiều tăng dần giá trị năng lượng liên kết: HI < HBr < HCl < HF
=> Sắp xếp theo chiều tăng dần độ bền liên kết: HI < HBr < HCl < HF