Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: $n_{Al}=n_{Fe}=0,1(mol)$
Sau phản ứng thì Al hết, Fe chưa phản ứng hoặc còn dư
Gọi số mol $Cu(NO_3)_2 và $AgNO_3$ lần lượt là a;b
Ta có: $64a+108b=28$
Bảo toàn e toàn bộ quá trình ta có: $2a+b=0,4$
Giải hệ ta được $a=0,1;b=0,2$
$\Rightarrow [Cu(NO_3)_2]=1M;[AgNO_3]=2M$
\(n_{H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(\Rightarrow n_{Fe\left(dư\right)}=0.05\left(mol\right)\)
\(n_{Al}=n_{Fe}=a\left(mol\right)\)
\(\Rightarrow a=\dfrac{8.3}{27+56}=0.1\)
\(n_{AgNO_3}=x\left(mol\right),n_{Cu\left(NO_3\right)_2}=y\left(mol\right)\)
\(m_{cr}=108x+64y=28\left(1\right)\)
Bảo toàn e :
\(x+2y=0.4\left(2\right)\)
\(\left(1\right),\left(2\right):x=0.2,y=0.1\)
\(C_{M_{AgNO_3}}=\dfrac{0.2}{0.1}=2\left(M\right)\)
\(C_{M_{Cu\left(NO_3\right)_2}}=\dfrac{0.1}{0.1}=1\left(M\right)\)

nH+=0,4+0,1.a
nNO3-=0,1a
bạn viết phương trình Mg+H+ +NO3- dưới dạng pt ion
H++NO3 ttuowng đương với HNO3 loãng
rồi bạn sử dụng phương pháp đường chéo, định luật bảo toàn nguyên tố và electron

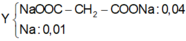

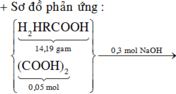
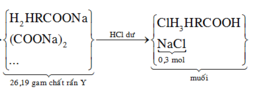
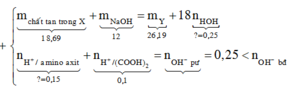

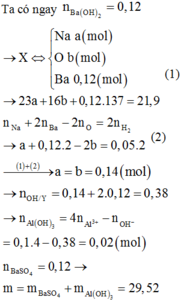
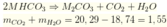
Mk trình bày lại nhé
\(\text{nH2 đề bài = 0,3 mol}\)
nH2 (do axit) = nH2SO4 + 0,5.nHCl\(\text{ = 0,05 + 0,5.0,1 = 0,1 mol}\)
Ta thấy: 0,3 > 0,1 nên suy ra axit hết, có phản ứng của Na với H2O
nH2 (do Na pư với H2O) = 0,3 - 0,1 = 0,2 mol
\(\text{2Na + H2SO4 → Na2SO4 + H2}\)
________ 0,05______0,05________
\(\text{Na + HCl → NaCl + 0,5H2}\)
____ 0,1 ____0,1______________
\(\text{Na + H2O → NaOH + 0,5H2}\)
____________0,4___________0,2
Cô cạn dd thu được chất rắn là:
\(\text{m chất rắn = mNa2SO4 + mNaCl + mNaOH}\)
\(\text{ = 0,05.142 + 0,1.58,5 + 0,4.40 = 28,95 gam}\)