Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H2}=\frac{8,96}{22,4}=0,4\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Al}:x\left(mol\right)\\n_{Zn}:y\left(mol\right)\end{matrix}\right.\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
x____3x ________________1,5x
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
y_____2y_______________y
Giải hệ PT
\(\left\{{}\begin{matrix}1,5z+y=0,4\\27x+65y=11,9\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
a,
\(\Rightarrow\left\{{}\begin{matrix}\%_{Al}=\frac{0,2.27}{11,9}.100\%=45,38\%\\\%_{Zn}=100\%-45,38\%=54,62\%\end{matrix}\right.\)
b, \(n_{HCl}=0,2.3+0,1.2=0,8\left(mol\right)\)
\(\Leftrightarrow20=\frac{0,8.36,5.100}{m_{dd}}\)
\(\Rightarrow m=146\left(g\right)\)

Đáp án A
Số mol các chất là:
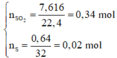
Sơ đồ phản ứng:
Al Zn ⏟ 11 , 9 g a m + H 2 S O 4 ( đ ặ c ) → Al 2 ( SO 4 ) 3 ZnSO 4 ⏟ M u ố i + S O 2 ⏟ 0 , 34 mol S ⏟ 0 , 02 m o l + H 2 o
Áp dụng công thức của bài toán kim loại tác dụng với H2SO4 đặc ta có:

bài 1
Gọi số mol Cl2 và O2 lần lượt là x , y
=> x + y = 0,3 mol (1)
Ta có:
Bảo toàn e: ∑ne cho = ∑ne nhận
=> 2x+4y = 0,8 (2)
Từ (1) và (2) => x = 0,2 và y = 0,1
=> %mO2 = 0,1.32 : (0,1.32 + 0,2.71).100 = 18,4%
bài 2
Có:
Áp dụng định luật bảo toàn khối lượng ta có:
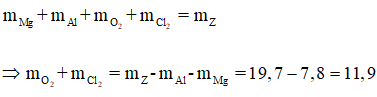
Gọi
Có:
Gọi
Có
Vậy

Gọi x,y lần lượt là số mol của Zn và Al
Theo đề ta có mHỗnhợp=65x+27y=9,2(1)
nSO2=5,6:22,4=0,25mol
BTE:2x+3y=2.0,25=0,5(2)
Từ (1) và (2) => x=0,1;y=0,1
mAl=0,1.27=2,7g
Gọi x,y lần lượt là số mol của Zn và Al
Theo đề ta có mHỗnhợp=65x+27y=9,2(1)
nSO2=5,6:22,4=0,25mol
BTE:2x+3y=2.0,25=0,5(2)
Từ (1) và (2) => x=0,1;y=0,1
mAl=0,1.27=2,7g
Chúc bạn học tốt!!!

a)
Gọi $n_{Zn} = a(mol) ; n_{Al} = b(mol) \Rightarrow 65a + 27b = 11,9(1)$
$Zn + 2HCl \to ZnCl_2 + H_2$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
Theo PTHH :
$n_{H_2} = a + 1,5b = \dfrac{8,96}{22,4} = 0,4(2)$
Từ (1)(2) suy ra : a = 0,1; b = 0,2
$m_{Zn} = 0,1.65 = 6,5(gam)$
$m_{Al} = 0,2.27 = 5,4(gam)$
b) $n_{HCl} = 2n_{H_2} = 0,8(mol)$
$C\%_{HCl} = \dfrac{0,8.36,5}{125}.100\% = 23,36\%$

Câu 1:
Gọi \(\left\{{}\begin{matrix}n_{Cu}:x\left(mol\right)\\n_{Fe}:y\left(mol\right)\end{matrix}\right.\)
\(Cu+Cl_2\rightarrow CuCl_2\)
\(Fe+Cl_2\rightarrow FeCl_2\)
\(\left\{{}\begin{matrix}64x+56y=30,4\\2x+3y=1,2\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,3\\y=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Cu}=0,3.64=19,2\left(g\right)\\m_{Fe}=0,2.56=11,2\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Cu}=63,16\%\\\%m_{Fe}=36,84\%\end{matrix}\right.\)
BTNT Cl:
\(n_{AgCl}=2.n_{Cl2}=1,2\left(mol\right)\)
\(\Rightarrow m_{AgCl}=172,2\left(g\right)\)
Câu 2:
Gọi \(\left\{{}\begin{matrix}n_{Al}:x\left(mol\right)\\n_{Zn}:y\left(mol\right)\end{matrix}\right.\)
\(2Al+6HCl2\rightarrow AlCl_3+3H_2\)
x______________x________3x/2
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
y___________y_________y
\(m_{kl}=27x+65y=3,57\left(1\right)\)
\(m_{muoi}=133,5x+136y=12,09\left(2\right)\)
\(\left(1\right)+\left(2\right)\Rightarrow\left\{{}\begin{matrix}x=0,06\\y=0,03\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,06.27=1,62\left(g\right)\\m_{Zn}=0,03.65=1,95\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%_{Al}=45,38\%\\\%_{Zn}=54,62\%\end{matrix}\right.\)
Bảo toàn e: \(n_{H2}=0,12\left(mol\right)\Rightarrow V=\frac{32}{12}=2,46\left(l\right)\)

Gọi \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\end{matrix}\right.\) => 65a + 56b + 27c = 10,65 (1)
PTHH: Zn + 2HCl --> ZnCl2 + H2
Fe + 2HCl --> FeCl2 + H2
2Al + 6HCl --> 2AlCl3 + 3H2
=> \(n_{H_2}=a+b+1,5c=\dfrac{5,04}{22,4}=0,225\left(mol\right)\) (2)
PTHH: Zn + Cl2 --to--> ZnCl2
2Fe + 3Cl2 --to--> 2FeCl3
2Al + 3Cl2 --to--> 2AlCl3
=> \(n_{Cl_2}=a+1,5b+1,5c=\dfrac{5,6}{22,4}=0,25\left(mol\right)\) (3)
(1)(2)(3) => \(\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,05\left(mol\right)\\c=0,05\left(mol\right)\end{matrix}\right.\) => \(\left\{{}\begin{matrix}m_{Zn}=0,1.65=6,5\left(g\right)\\m_{Fe}=0,05.56=2,8\left(g\right)\\m_{Al}=0,05.27=1,35\left(g\right)\end{matrix}\right.\)
a) \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{6,5}{10,65}.100\%=61,033\%\\\%m_{Fe}=\dfrac{2,8}{10,65}.100\%=26,291\%\\\%m_{Al}=\dfrac{1,35}{10,65}.100\%=12,676\%\end{matrix}\right.\)
b) nHCl = 2a + 2b + 3c = 0,45 (mol)
=> mHCl = 0,45.36,5 = 16,425 (g)
=> \(a\%=C\%=\dfrac{16,425}{200}.100\%=8,2125\%\)
c) mdd sau pư = 10,65 + 200 - 0,225.2 = 210,2 (g)
=> \(\left\{{}\begin{matrix}C\%_{ZnCl_2}=\dfrac{0,1.136}{210,2}.100\%=6,47\%\\C\%_{FeCl_2}=\dfrac{0,05.127}{210,2}.100\%=3,02\%\\C\%_{AlCl_3}=\dfrac{0,05.133,5}{210,2}.100\%=3,176\%\end{matrix}\right.\)

a) \(\text{Đặt }n_{Cl_2}=x\left(mol\right);n_{O_2}=y\left(mol\right)\)
\(\Rightarrow n_{kh\text{í}}=x+y=0,5\left(1\right)\)
\(BTKL\Rightarrow m_{kh\text{í}}=m_Z-m_{KL}=25,36\left(g\right)\\ \Rightarrow71x+32y=25,36\left(2\right)\)
Từ (1) và \(\left(2\right)\Rightarrow\left\{{}\begin{matrix}x=0,24\\y=0,26\end{matrix}\right.\)
\(\Rightarrow\%V_{O_2}=52\%\)
b) \(\text{Đặt }n_{Mg}=a\left(mol\right);n_{Al}=b\left(mol\right)\)
\(\Rightarrow m_{KL}=24x+27y=16,98\left(3\right)\)
\(BT\text{ }e\Rightarrow2n_{Mg}+3n_{Al}=2n_{Cl_2}+4n_{O_2}\\ \Rightarrow2a+3b=1,52\left(4\right)\)
Từ (3) và \(\left(4\right)\Rightarrow\left\{{}\begin{matrix}a=0,55\\b=0,14\end{matrix}\right.\)
\(\Rightarrow\%Mg=77,74\%\)
Sao câu b ở trên đang đặt ẩn mol là a, b ở dưới lại có x y vậy bạn

1/ 4Al + 3O2 => 2Al2O3
2Cu + O2 => 2CuO
nO2 = V/22.4 = 4.48/22.4 = 0.2 (mol)
Gọi x,y (mol) lần lượt là số mol của Al và Cu
Theo đề bài và phương trình trên ta có:
27x + 64y = 11.8
3/4x + 1/2y = 0.2
Dùng máy tính giải hệ phương trình (hoặc có thể giải tay) ta được:
x = 0.2; y = 0.1
mAl = n.M = 0.2 x 27 = 5.4 (g)
mCu = n.M = 0.1 x 64 = 6.4 (g)
%Al = 5.4 x 100/11.8
%Cu = 6.4 x 100/11.8
2/ 2Mg + O2 => 2MgO (đk : to)
Mg + Cl2 => MgCl2 (đk : to)
V khí = 6.72 (l) =====> n khí = V/22.4 = 0.3 (mol)
nMg = m/M = 9.6/24 = 0.4 (mol)
Gọi x,y (mol) lần lượt là số mol của O2 và Cl2.
Theo đề bài và phương trình ta có:
x + y = 0.3; 2x + y = 0.4
Giải hệ phương trình ta được:
x = 0.1, y = 0.2
%O2 = 0.1 x 100/0.3
%Cl2 = 0.2 x 100/0.3
nO2 = 1/2 nCl2, O2 = 32, Cl2 = 71
==> M = 58
==> dM/H2 = 58/2 = 29
Giúp em với
Có \(\left\{{}\begin{matrix}71.n_{Cl_2}+32.n_{O_2}=11,9\\n_{Cl_2}+n_{O_2}=\dfrac{5,6}{22,4}=0,25\end{matrix}\right.=>\left\{{}\begin{matrix}n_{Cl_2}=0,1\\n_{O_2}=0,15\end{matrix}\right.\)
Gọi số mol Zn, Al là a, b
=> 65a + 27b = 11,9
Al0-3e-->Al+3
b->3b
Zn0-2e-->Zn+2
a-->2a
Cl20 +2e--> 2Cl-
0,1->0,2
O20 +4e--> 2O-2
0,15->0,6
Bảo toàn e: 2a + 3b = 0,8
=> a = 0,1 ; b = 0,2
=> mAl = 0,2.27 = 5,4 (g)