Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Độ tan của muối Na 2 CO 3 ở 18 º C là: S = (53 x 100)/250 = 21,2 (gam).

Ở nhiệt độ 18oC 250g nước hòa tan 53g Na2CO3 để tạo dung dịch bão hòa. Vậy ở nhiệt độ 18oC, 100g nước hòa tan Sg Na2CO3 tạo dung dịch bão hòa.
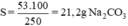
Theo định nghĩa về độ tan, ta có độ tan của Na2CO3 ở 18oC là 21,2g.

Giải:
a)Độ tan của muối NaCl ở nhiệt độ 28oC là:
S=\(\dfrac{m_{ct}}{m_{dm}}\) .100=\(\dfrac{20}{250}\).100= 8(g)
b)mdd thu được=mct+mdm=20+250= 270(g)
nồng độ % của dung dịch trên là:
C% = \(\dfrac{m_{ct}^{ }}{_{ }m_{dd}}\).100% = \(\dfrac{20}{270}\).100%= <bạn tự tính nha>

a) mdd =15+65=80g
b)
⇒SNa2CO3=\(\dfrac{53}{250}\).100=21,2g
Vậy độ tan của muối Natricacbonat ở 18 độ C là 21,2g
a. mdd = 15+65 = 80 (g)
b. Độ tan của muối Na2CO3 ở 18^oC là : S = (53 x 100)/250 = 21,2 (gam).

S=\(\dfrac{53.100}{250}=21,2gNa2CO3\)
Theo định nghĩa về độ tan, ta có độ tan của Na2CO3 ở 18oC là 21,2g

1)
S = m Na2SO4 / m H2O .100 = 7,2/80 .100 = 9(gam)
C% Na2SO4 = S/(S + 100) . 100% = 9/109 . 100% = 8,26%
2)
a)m dd HNO3 = D.V = 50.1,25 = 62,5 gam
b) m HNO3 = 62,5.40% = 25(gam)
c) n HNO3 = 25/63 (mol)
=> CM HNO3 = (25/63) / 0,05 = 7,94M
d)
n HNO3 = 0,2.0,25 = 0,05(mol)
mdd HNO3 40% = 0,05.63/40% = 7,875 gam
Vdd HNO3 40% = 7,875/1,25 = 6,3 ml
=> V nước = 200 -6,3 = 193,7 ml
Pha chế :
Chuẩn bị 7,875 gam dd HNO3 40% vào cốc
Thêm từ từ 193,7 ml nước vào cốc,khuấy đều
\(S_{Na_2CO_3}=\dfrac{53}{250}.100=21,2\)
\(C\%=\dfrac{53}{250+53}.100\%=17,5\%\)