Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

![]()
= 12,8 + 2.0,3 = 13,4 g
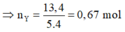
⇒ n H 2 p h ả n ứ n g = 0.
![]()
· Đốt cháy Y:
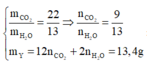
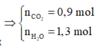
=> Đốt cháy X được:
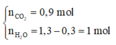
![]()
=> Đặt công thức chung cho X là C1,8H4.
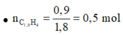
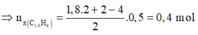
→
B
T
l
i
ê
n
k
ế
t
![]()
= 0,12 mol
![]()
=> Chọn đáp án A.

BTKL: mY = mX = 0,4.2 + 0,2.26 = 6 (g)
=> \(n_Y=\dfrac{6}{7,5.2}=0,4\left(mol\right)\)
mH2(pư) = nX - nY = (0,4 + 0,2) - 0,4 = 0,2 (mol)
Gọi số mol Br2 pư là a (mol)
Bảo toàn liên kết: 2.0,2 = 0,2 + a
=> a = 0,2 (mol)
=> mBr2 = 0,2.160 = 32 (g)

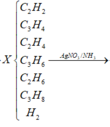
Bài này cũng cho số liệu dạng tương đối vì thế ta có thể tự chọn lượng chất để giải. Khi crakinh butan ta có các phản ứng xảy ra:
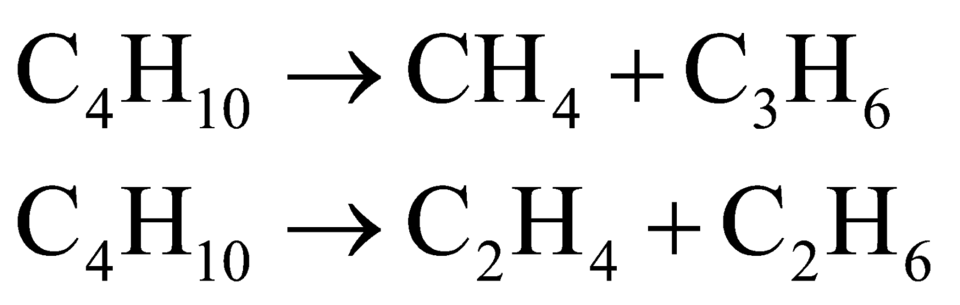
Do đó hỗn hợp X gồm 5 hidrocacbon là CH4, C3H6, C2H4, C2H6 và C4H10 dư. Khi cho hỗn hợp Y qua xúc tác Ni Nung nóng:
![]()
![]()
Vì các phản ứng xảy ra hoàn toàn và hỗn hợp khí Z thu được sau phản ứng không có khả năng làm nhạt màu dung dịch brom nên trong Z không còn các anken. Do đó các anken đã phản ứng hết.
Chọn 4 mol hỗn hợp Y thì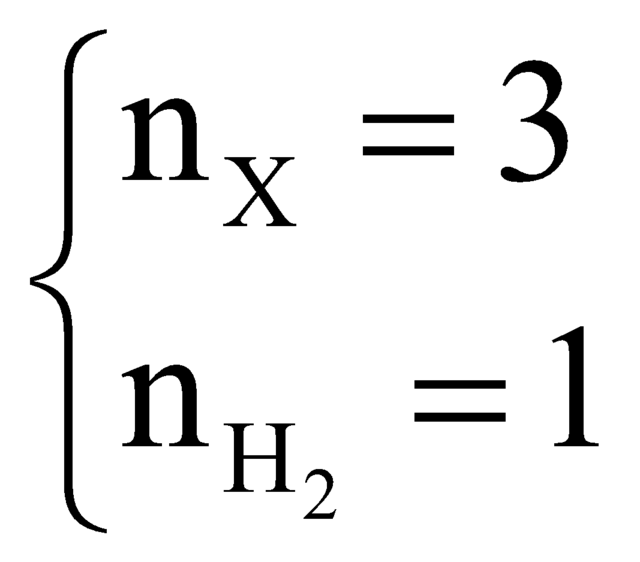
Vì hỗn hợp Z có thể tích giảm 25% so với Y nên tổng thể tích khí trong Z là 3.
Có nanken = ![]() = nkhí giảm = nY - nZ = 1(mol)
= nkhí giảm = nY - nZ = 1(mol)
Do đó trong hỗn hợp X có 1 mol anken và 2 mol ankan.
Mà khi crakinh thì nankan mới = nanken
![]()
![]()
Vậy H = 1/ 2.100% = 50%
Đáp án A.
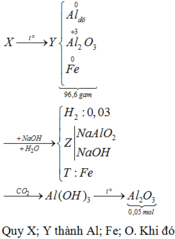
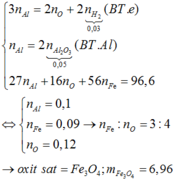
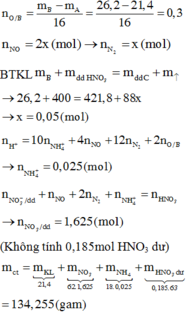

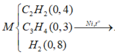
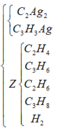
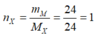
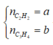
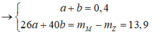
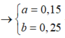
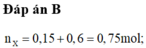
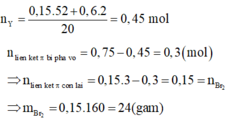
Xét `a<b->H` tính theo `Fe.`
`Fe+S` $\xrightarrow{t^o}$ `FeS`
`0,5a->0,5a->0,5a(mol)`
Có `n_{Fe\ pu}=0,5a(mol)`
`Y` gồm `Fe:0,5a(mol);S:b-0,5a(mol);FeS:0,5a(mol)`
`FeS+2HCl->FeCl_2+H_2S`
`Fe+2HCl->FeCl_2+H_2`
Theo PT: `n_{H_2S}=n_{FeS}=0,5a(mol);n_{H_2}=n_{Fe}=0,5a(mol)`
`->{n_{H_2S}}/{n_{H_2}}={5.2-2}/{34-5.2}=1/3`
``->{0,5a}/{0,5a}=1/3` vô lí.
Xét `a>b->H` tính theo `S.`
`Fe+S` $\xrightarrow{t^o}$ `FeS`
`0,5b←0,5b->0,5b(mol)`
Có `n_{S\ pu}=0,5b(mol)`
`Y` gồm `Fe:a-0,5b(mol);S:0,5b(mol);FeS:0,5b(mol)`
`FeS+2HCl->FeCl_2+H_2S`
`Fe+2HCl->FeCl_2+H_2`
Theo PT: `n_{H_2S}=n_{FeS}=0,5b(mol);n_{H_2}=n_{Fe}=a-0,5b(mol)`
`->{n_{H_2S}}/{n_{H_2}}={5.2-2}/{34-5.2}=1/3`
``->{0,5b}/{a-0,5b}=1/3`
`->1,5b=a-0,5b`
`->a=2b`
`->a:b=2:1`
`->{0,5b}/{a-0,5b}=1/3`