Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(FeO+H_2\underrightarrow{t^o}Fe+H_2O\)
b, \(n_{FeO}=\dfrac{7,2}{72}=0,1\left(mol\right)\)
\(n_{Fe}=n_{FeO}=0,1\left(mol\right)\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
c, \(n_{H_2}=n_{FeO}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)

a.b.\(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,3 0,2 0,1 ( mol )
\(m_{Fe_3O_4}=0,1.232=23,2\left(g\right)\)
\(V_{O_2}=0,2.22,4=4,48\left(l\right)\)
c. \(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,3 > 0,15 ( mol )
0,225 0,15 0,075 ( mol )
\(m_{Fe_3O_4}=0,075.232=17,4\left(g\right)\)
d. \(n_{H_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
\(Fe_3O_4+4H_2\rightarrow\left(t^o\right)3Fe+4H_2O\)
0,075 < 0,35 ( mol )
0,075 0,3 ( mol )
Chất dư là H2
\(m_{H_2\left(dư\right)}=\left(0,35-0,3\right).2=0,1\left(g\right)\)

\(n_{Cu}=\dfrac{6,4}{64}=0,1mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,1 0,1 ( mol )
\(\left\{{}\begin{matrix}m_{CuO}=0,1.80=8g\\m_{FeO}=12-8=4g\end{matrix}\right.\)

a)
FeO + H2 --to--> Fe + H2O
CuO + H2 --to--> Cu + H2O
b) \(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
0,1<--0,1<-----0,1
=> \(m_{FeO}=12-0,1.80=4\left(g\right)\)
=> \(n_{FeO}=\dfrac{4}{72}=\dfrac{1}{18}\left(mol\right)\)
FeO + H2 --to--> Fe + H2O
\(\dfrac{1}{18}\)-->\(\dfrac{1}{18}\)----->\(\dfrac{1}{18}\)
=> \(V_{H_2}=\left(0,1+\dfrac{1}{18}\right).22,4=\dfrac{784}{225}\left(l\right)\)
c) \(m_{Fe}=\dfrac{1}{18}.56=\dfrac{28}{9}\left(g\right)\)
d) \(\left\{{}\begin{matrix}m_{CuO}=0,1.80=8\left(g\right)\\m_{FeO}=4\left(g\right)\end{matrix}\right.\)

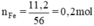
Phương trình hóa học của phản ứng:
Fe2O3 + 3H2 → 2Fe + 3H2O.
Khử 1 mol Fe2O3 cho 2 mol Fe.
x mol Fe2O3 → 0,2 mol.
x = 0,2 : 2 =0,1 mol.
m = 0,1 .160 =16g.
Khử 1 mol Fe2O3 cần 3 mol H2.
Vậy khử 0,1 mol Fe2O3 cần 0,3 mol H2.
V= 0,3 .22.4 = 6,72l.

Câu 1: PTHH: Fe2O3 + 3CO ===>Fe + 3CO2
Áp dụng định luật bảo toàn khối lượng
=> mFe = mFe2O3 + mCO - mCO2
= 32 + 16,8 - 26,4 = 22,4 kg
Câu 2/
a/ PTHH: CuCO3 ==( nhiệt)==> CuO + CO2
Cu(OH)2 ==(nhiệt)==> CuO + H2O
Áp dụng định luật bảo toàn khối lượng
=> mCO2 = mmalachite - mCuO - mH2O
= 2,22 - 1,60 - 0,18 = 0,44 gam
b/ Áp dụng định luật bảo toàn khối lượng
=> mquặng = mCuO + mCO2 + mH2O
= 6 + 0,9 + 2,2 = 9,1 gam

hình như bn ghi sai r đó phải là:đồng oxit mới phải chứ![]()
Ta có: \(n_{Fe}=\dfrac{6,72}{56}=0,12\left(mol\right)\)
PT: \(2Fe+O_2\underrightarrow{t^o}2FeO\)
Theo PT: \(\left\{{}\begin{matrix}n_{FeO}=n_{Fe}=0,12\left(mol\right)\\n_{O_2}=\dfrac{1}{2}n_{Fe}=0,06\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{FeO}=0,12.72=8,64\left(g\right)\)
\(V_{O_2}=0,06.24,79=1,4874\left(l\right)\)